时间:2017-08-06 09:34:00
1、选择题 常温下,用0.1000mol/L?HCl溶液滴定?20.00mL?0.1000mol/L?NH3?H2O溶液滴定曲线如图.下列说法正确的是( )
A.点①溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.点②溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.点③溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)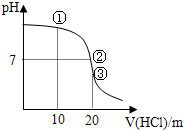
2、选择题 25°C时,几种弱酸溶液的pH如下表所示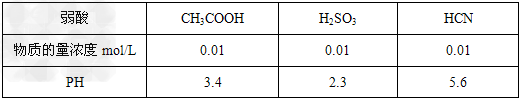
下列有关说法正确的是
[ ? ]
A.相同pH的CH3COOH与HCN溶液中水电离的氢离子浓度CH3COOH溶液中的大
B.物质的量浓度相同的CH3COONa与NaCN溶液中,各离子浓度之和两者相等
C.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在如下关系:Ka·K?=?Kw
D.0.01mol/L的Na2SO3溶液与0.01mol/L的CH3COONa溶液相比,一定是后者的碱性强
3、填空题 某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A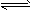 H++HA-,HA-
H++HA-,HA-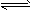 H++A2-。回答下列问题:
H++A2-。回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性” ),理由是(用离子方程式表示)
_____________________________。
(2)若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能是_______
0.11mol/L(填“>”、“=”、“<” )。理由是: _____________________________________。
(3)NaHA溶液中各离子浓度由大到小的顺序是: ______________________________。
4、选择题 25℃时,某一元酸(HB)的盐NaB的水溶液呈碱性,下列叙述正确的是
[? ]
A.HB的电离方程式为:HB==H++B-
B.NaB溶液中:c(Na+)>c(B-)>c(H+)>c(OH-)
C.NaB溶液中存在如下关系:c(Na+)+c(H+)==c(HB)+c(B-)
D.0.1mol/L NaB溶液中水电离的OH-浓度大于10-7mol/L
5、选择题 等物质的量浓度的下列溶液中,c(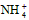 )最大的是
)最大的是
[?]
A. NH4HCO3
B. NH4NO3
C. (NH4)2CO3
D. NH4HSO4