时间:2017-08-06 09:22:43
1、选择题 下列关于电解KNO3溶液时的叙述正确的是
A. 向阴极移动,K+向阳极移动,分别在对应的极上析出
向阴极移动,K+向阳极移动,分别在对应的极上析出
B.随电解的进行,溶液的pH减小
C.OH-向阳极移动,阳极附近溶液显碱性
D.阴极上H+得电子被还原成H2,促进水的电离平衡正向移动,富集下来的OH-使得阴极附近溶液呈碱性
参考答案:D
本题解析:根据电解原理,溶液中的阴离子 、OH-定向向阳极移动后,OH-失电子被氧化生成O2,因而阳极区OH-浓度迅速减小,使得c(H+)>c(OH-),故阳极附近溶液显酸性;另溶液中的阳离子K+、H+定向向阴极移动后,H+得电子生成H2,因而使得阴极区H+浓度迅速减小,使得c(OH-)>c(H+),故阴极附近溶液显碱性。
、OH-定向向阳极移动后,OH-失电子被氧化生成O2,因而阳极区OH-浓度迅速减小,使得c(H+)>c(OH-),故阳极附近溶液显酸性;另溶液中的阳离子K+、H+定向向阴极移动后,H+得电子生成H2,因而使得阴极区H+浓度迅速减小,使得c(OH-)>c(H+),故阴极附近溶液显碱性。
本题难度:简单
2、实验题 已知反应AsO43-+2I-+2H+ AsO33-+I2+H2O是可逆反应。现设计如下图所示实验装置(装置中盐桥的作用是使整个装置形成一个闭合的回路)进行下述操作:
AsO33-+I2+H2O是可逆反应。现设计如下图所示实验装置(装置中盐桥的作用是使整个装置形成一个闭合的回路)进行下述操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安表指针偏转;
(Ⅱ)若改向(B)烧杯中滴加40%NaOH溶液,发现微安表指针偏转方向与Ⅰ相反。
试完成下列问题:
(1)两次操作过程中微安表指针为什么会发生偏转?
(2)两次操作过程中指针偏转方向为什么相反?
参考答案:(1)两次操作均发生原电池反应,电流表指针偏转,化学能转变为电能。
(2)由于c(H+)改变,使化学平衡向不同方向移动发生不同方向的反应。
本题解析:Ⅰ.操作过程中,C1棒发生的反应为2I--2e-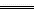 I2
I2
Ⅱ.操作过程中,C2棒发生的反应为AsO33-+H2O-2e-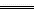 AsO43-+2H+
AsO43-+2H+
总反应为AsO43-+2I-+2H+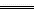 AsO33-+I2+H2O,Ⅰ操作中I-被氧化,AsO43-被还原;Ⅱ操作中AsO43-被氧化,I2被还原。
AsO33-+I2+H2O,Ⅰ操作中I-被氧化,AsO43-被还原;Ⅱ操作中AsO43-被氧化,I2被还原。
Ⅰ操作中(A)池发生氧化反应C1为负极;(B)池中发生还原反应C2为正极。
Ⅱ操作中(A)池发生还原反应C1为正极;(B)池中发生氧化反应C2为负极。
本题难度:一般
3、选择题 按图a中装置进行实验,图中两电极均为银棒,若图b的X轴表示流入电极的电子的量,则Y轴不可能表示的情况是( )
A.c(Ag+)
B.c(NO3-)
C.溶液的pH
D.银棒质量
参考答案:由图a可知,Ag连接电源的正极,则为阳极,电解质溶液为硝酸银溶液,
则该装置实际上是在铁的表面电镀银,电解质溶液的浓度不变,即Ag+、NO3-的浓度不变,溶液的浓度及pH不变,故A、B、C都可能;
而图b中,Y轴表示某个量不变,
阳极上Ag溶解,阴极上Ag析出,则阴极质量增大,阳极质量减小,故D不可能,
故选D.
本题解析:
本题难度:简单
4、选择题 某同学设计了一种电解法制取Fe(OH)2的实验装置(如图)。通电后,溶液中产生白色沉淀,且较长时间不变色。下列说法中正确的是 
[? ]
A.电源中a为负极,b为正极
B.电解池中的电解液不可以是NaCl溶液
C.B电极发生的反应:2H2O+2e-=H2↑+2OH-
D.A、B两端都必须使用铁作电极
参考答案:C
本题解析:
本题难度:一般
5、选择题 用惰性电极电解下列足量溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是( )
A.NaCl[盐酸溶液]
B.NaOH[NaOH]
C.AgNO3[Ag2O]
D.CuSO4[Cu(OH)2]
参考答案:A.惰性电极电解氯化钠溶液,电极生成物是氯气、氢气和氢氧化钠,所以需要加入的是氯化氢,故A错误;
B.惰性电极电解氢氧化钠溶液,实质是电解水,加入的应该是水,故B错误;
C.电解AgNO3溶液生成Ag和氧气,需要加入的是Ag2O,故C正确;
D.惰性电极电解硫酸铜溶液,生成物是铜、氧气和硫酸,所以需要加入的是氧化铜或碳酸铜,故D错误.
故选C.
本题解析:
本题难度:简单