时间:2017-08-06 09:22:43
1、选择题 用铂作电极电解下列溶液,当消耗相同电量时,在阴极上有金属析出且溶液的pH下降的是
A.KCl
B.CuCl2
C.CuSO4
D.HCl
参考答案:C
本题解析:在阴极上有金属析出,则溶液中须有不活泼金属阳离子,排除AD选项。电解CuCl2生成铜和氯气,放电完毕体系中只剩下水,显中性,故电解过程pH增大,B错。电解CuSO4会生成硫酸,溶液的pH下降,故选C
本题难度:一般
2、选择题 某同学按图所示的装置进行电解实验。下列说法正确的是
[? ]
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
参考答案:BC
本题解析:
本题难度:一般
3、实验题 (8分)某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
实验1:如图所示连接装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细.电解开始30 s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色.
实验2:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸溶液 | 沉淀溶解,有无色气泡产生,最终得到蓝色溶液 |
| ② | 滴入稀硫酸溶液 | 橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜(不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色或橙黄色 | 氯化亚铜 | 白色 |
参考答案:(1)+1 +2 Cu2O?(2)2H++2e-===H2↑
Cu+Cl--e-===CuCl↓(或Cu+OH--e-===CuOH↓)
(3)①3Cu2O+14H++2NO===6Cu2++2NO↑+7H2O
②Cu2O+2H+===Cu+Cu2++H2O
本题解析:(1)铜有+1价和+2价,据实验1的现象说明橙黄色沉淀较稳定,再结合铜的化合物的颜色知该物质应为Cu2O,而Cu2O也符合实验2中的要求。
(2)在阴极上H+放电,反应为2H++2e-===H2↑,而阳极为铜,据现象及信息知反应为Cu-e-+Cl-===CuCl↓。
(3)Cu2O与稀HNO3发生了氧化还原反应,方程式为
3Cu2O+14H++2NO===6Cu2++2NO↑+7H2O,Cu2O与H2SO4反应,据反应现象知产物有CuSO4与Cu生成,故反应为Cu2O+2H+===Cu+Cu2++H2O。
本题难度:一般
4、选择题 将H2S通入FeCl3 溶液中,过滤后将反应液加入电解槽中电解(如下图所示)电解后的溶液还可以循环利用。该方法可用于处理石油炼制过程中产生的H2S废气。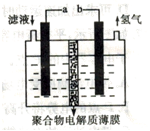
下列有关说法正确的是
A.过滤得到的沉淀可能是FeS和S
B.若有0.20mol的电子转移,一定能得到2.24L的氢气
C.可以用Fe与外接电源的a极相连
D.与a极相连的电极反应为Fe2+-2e-=Fe3+
参考答案:D
本题解析:A、氯化铁溶液具有氧化性,能把氯化氢氧化生成单质S、氯化亚铁和氯化氢,得不到硫化亚铁,A错误;B、不能确定氢气的状态,因此不能计算氢气的体积,B错误;C、b电极产生氢气,这说明b电极负极,与之相连的电极是阴极,溶液中的氢离子放电生成氢气,则a电极是正极。如果铁是阳极,则铁失去电子,得不到氯化铁,不能循环利用,C错误;D、与a极相连的电极是阳极,电极反应为Fe2+-2e-=Fe3+,D正确,答案选D。
考点:考查氧化还原反应和电解池原理的应用
本题难度:一般
5、填空题 (9分)X~R是元素周期表中的短周期元素,其相关信息如下表:
| 元素 | X | Y | Z | W | R |
| 相关信息 | 能形成+7价的化合物 | 日常生活中常见的金属,熔化时并不滴落,好像有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子 | 焰色反应为黄色 | 最外层有二个未成对电子,无正价 |
 部分电离),阳极反应式是
部分电离),阳极反应式是 ,阴极反应式是 ;已知1mol
,阴极反应式是 ;已知1mol 与水反应得到C时转移了2 mol e-,则该反应的离子方程式是 。
与水反应得到C时转移了2 mol e-,则该反应的离子方程式是 。 参考答案:(1) M (2)  ,SP3 NH3
,SP3 NH3
本题解析:
本题难度:困难