时间:2017-08-06 09:15:44
1、选择题 室温时,M(OH)2(s)  M2+(aq)+2OH-(aq) Ksp="a" ,c(M2+)="b" mol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq) Ksp="a" ,c(M2+)="b" mol·L-1时,溶液的pH等于
A.
B.
C.14+
D.14+
参考答案:C
本题解析:Ksp=c(M2+)?c2(OH-)=a;由于c(M2+)="b" mol/L,所以c2(OH-)=a/b,c(OH-)= ,c(H+)=Kw÷c(OH-)=10-14
,c(H+)=Kw÷c(OH-)=10-14 ;所以pH=-lg10-14
;所以pH=-lg10-14 =14+
=14+ ;故选项是C。
;故选项是C。
考点:考查沉淀溶解平衡常数的应用、溶液的pH的计算的知识。
本题难度:一般
2、选择题 在溶液中有浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39; Ksp[Cr(OH)3] =7.0×10-31 Ksp[Zn(OH)2] =1.0×10-17; Ksp[Mg(OH)2] =1.8×10-11当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
[? ]
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
参考答案:A
本题解析:
本题难度:一般
3、填空题 (1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
参考答案:(1)B; CD
(2)4 ;3.3 ;可行
本题解析:
本题难度:一般
4、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列说法正确的是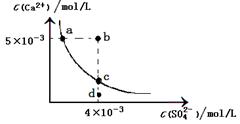
A.CaSO4在稀硫酸中的溶解性与在纯水中的溶解性相同
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
参考答案:
本题解析:稀硫酸中c(SO42-)大,抑制溶解,A不正确。B点溶液中离子积大于9×10-6,所以一定有沉淀析出。由于起始时c(SO42-)小于c(Ca2+),所以平衡时c(SO42-)仍然小于c(Ca2+),即c(SO42-)小于3×10-3 mol/L,C不正确。蒸发过程中c(SO42-)应该是增大的,所以选项C不正确。溶度积常数只与温度有关系,所以选项D正确,答案选D。
本题难度:一般
5、选择题 相同温度下,将足量的AgCl分别放入下列溶液中:
①20mL0.1mol/L(NH4)2CO3溶液 ②40mL0.02 mol/LBaCl2溶液
③40mL0.03 mol/L盐酸 ④10 mL蒸馏水
⑤50 mL0.05mol/LAgNO3溶液。则AgCl的溶解度大小顺序为:
A.①=②=③=④=⑤
B.①>④>③>②>⑤
C.⑤>④>①>③>②
D.④>③>⑤>①>②
参考答案:B
本题解析:①(NH4)2CO3水解产生的NH3·H2O与Ag+?形成络合物,促进溶解;②③中③的Cl―浓度小,溶解得多,④正常溶解⑤Ag+浓度大,溶解的量最少;选B。
本题难度:一般