时间:2017-08-06 09:07:56
1、选择题 下列式子中,属于水解反应的是:
A.H2O+H2O H3O++OH―
H3O++OH―
B.HCO3—+OH― H2O+CO32―
H2O+CO32―
C.CO2+H2O H2CO3
H2CO3
D.CO32―+H2O HCO3―+OH―
HCO3―+OH―
参考答案:D
本题解析:A选项属于水的电离;B选项的实质是酸碱中和反应;C选项是CO2溶于水的反应,该反应是个可逆反应。D选项为水解反应。故选D项。
点评:本题可以这样来理解,水解反应要有水参与反应,而A、C选项中反应一个是水的电离,另外一个是化合反应。
本题难度:一般
2、填空题 物质A~E都是由下表中的离子组成的,常温下将各物质的溶
液从1 mL稀释到1 000 mL,pH的变化关系如图甲所示,其中A与D反应得到E。请回答下列问题。
| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |
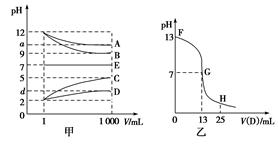
参考答案:(1)NaOH HCl
(2)NH3·H2O+H+=NH4++H2O
(3)①0.1 ②FG
③c(Na+)>c(OH-)≥c(CH3COO-)>c(H+)或c(Na+)>c(CH3COO-)≥c(OH-)>c(H+)
(4)12
本题解析:根据各物质的溶液从1 mL稀释到1 000 mL,pH的变化图象知,B和C溶液的pH变化为3,A和D溶液的pH变化小于3,则B为强碱,A为弱碱或强碱弱酸盐,C为强酸,D为弱酸或强酸弱碱盐,可先确定B为NaOH,C为HCl。结合A与D反应得到E,而E的pH不变,则E可能是NaCl或醋酸铵,结合B为NaOH,C为HCl,则推出E只能为醋酸铵,所以A为NH3·H2O,B为NaOH,C为HCl,D为CH3COOH。向NaOH溶液中滴加醋酸,起点pH=13,NaOH的浓度为0.1 mol·L-1。二者恰好完全反应生成醋酸钠,此时溶液显碱性,应该在FG区间。FG区间溶液呈碱性,c(OH-)>c(H+),所以c(Na+)>c(CH3COO-),c(CH3COO-)和c(OH-)的大小关系无法判断。根据t ℃时,稀氨水中c(H+)和c(OH-)的值可知该温度下水的离子积常数KW为10-13,所以将100 mL 0.2 mol·L-1的HCl溶液与100 mL 0.4 mol·L-1的NaOH溶液混合后,溶液呈碱性,c(OH-)=(100×0.4-100×0.2)/200(mol·L-1)=0.1 mol·L-1,c(H+)=KW/c(OH-)=10-12 mol·L-1,即pH=12。
本题难度:一般
3、选择题 对0.2mol·L-1碳酸钠溶液的微粒浓度分析正确的是?
A.[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+]
B.[Na+]+[H+]=[CO32-]+[HCO3-]+[OH-]
C.[OH-]=[H+]+[HCO3-]+[H2CO3]
D.[CO32-]+[HCO3-]+[H2CO3]=0.2mol·L-1
参考答案:A、D
本题解析:碳酸钠为强减弱酸盐,其溶液发生如下电离和水解过程:
Na2CO3====2Na++CO32-
CO32-+H2O HCO3-+OH-
HCO3-+OH-
HCO3-+H2O H2CO3+OH-
H2CO3+OH-
故溶液中存在的微粒有Na+、H+、OH-、CO32-、HCO3-、H2CO3等,它们的浓度关系:[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+]。按电荷守恒分析其浓度关系:
[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-]
按物料守恒分析其浓度关系:
[Na+]=[CO32-]+[HCO3-]+[H2CO3]
∵[Na+]=0.2mol·L-1,?∴[CO32-]+[HCO3-]+[H2CO3]=0.2mol·L-1。
本题难度:一般
4、选择题 下列混合溶液中,各离子浓度的大小顺序正确的是?
A.1mol·L-1氨水1mL与10mL0.1mol·L-1盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10mL0.1mol·L-1NH4Cl与5mL0.2mol·L-1NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol·L-1CH3COOH溶液与5mL0.2mol·L-1NaOH溶液混合:
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol·L-1CH3COONa溶液与6mL1mol·L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
参考答案:B
本题解析:A项中氨水与盐酸混合恰好反应生成氯化铵,所以溶液显酸性,A错。B项中NH4Cl与NaOH溶液混合恰好反应生成NH3·H2O和NaCl,溶液显碱性,B正确。C项混合后溶液中溶质为CH3COONa,CH3COO-要水解,C错。D项混合后溶质为CH3COOH 、HCl 、NaCl,溶液现酸性,D错。
本题难度:一般
5、选择题 草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.01 mol·L-1KHC2O4溶液中,下列关系正确的是?(?)
A.c (K+) + c (H+) =" c" (HC2O4-) + c (OH-) + c (C2O42-)
B.c (HC2O4-) + c (C2O42-) =" 0.01" mol·L-1
C.c (C2O42-) < c (H2C2O4)
D.c (K+) =" c" (H2C2O4) + c (HC2O4-) + c (C2O42-)
参考答案:D
本题解析:A不正确,不符号电荷守恒,应该是c (K+) + c (H+) =" c" (HC2O4-) + c (OH-) + 2c (C2O42-);B不正确,不符号物料守恒,应该是c (H2C2O4) +c (HC2O4-) + c (C2O42-) =" 0.01" mol·L-1。草酸氢钾溶液呈酸性,这说明电离出大于水解程度,则c (C2O42-)> c (H2C2O4),C不正确;D正确,符号物料守恒,答案选D。
点评:该题是中等难度的试题,试题贴近高考,综合性强。侧重对学生能力的培养,有利于调动学生的学习积极性。该题的关键是利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,并能结合题意灵活运用即可。
本题难度:一般