时间:2017-08-06 09:04:34
1、选择题 下列陈述I、II正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
| B | SO2有还原性 | SO2尾气可用NaOH溶液吸收 |
| C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| D | 锌金属活动性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
参考答案:D
本题解析:浓硫酸有吸水性可做干燥剂,但是因为有酸性不能干燥碱性气体,A错误;用氢氧化钠吸收SO2气体,体现的是SO2酸性氧化物的性质,无因果关系,B错误;电解制备金属镁,条件应该是电解熔融的氯化镁,C陈述错误;故选D。
本题难度:一般
2、选择题 下列变化规律中正确的是( )
A.H2S、H2O、PH3的热稳定性由弱到强
B.浓度均为0.2mol/L的醋酸、盐酸、硫酸的导电能力由弱到强
C.氯乙烷、2-氯丙烷、2-氯丁烷的密度由小到大
D.物质的量浓度相等的氯化钠、氯化镁、氯化铝三种溶液的pH值由小到大
参考答案:A、原子的得电子能力为O>S>P,故气态氢化物的稳定性顺序为:H2O>H2S>PH3,故A错误;
B、浓度均为0.2mol/L的醋酸、盐酸、硫酸中,硫酸完全电离出0.4mol/l的氢离子和0.2mol/L的硫酸根离子,盐酸完全电离出0.2mol/L的氢离子和0.2mol/L的氯离子,醋酸和盐酸比较,醋酸是一元弱酸,不能完全电离,故三种溶液中所有离子浓度大小顺序为:硫酸>盐酸>醋酸,故导电能力按醋酸、盐酸、硫酸的顺序由弱到强,故B正确;
C、密度与质量和体积的比值大小有关,不知三者的质量和体积,无法判断密度的大小,故C错误;
D、氯化钠显中性,氯化镁、氯化铝均水解显酸性,铝离子水解程度大于镁离子,酸性氯化铝强于氯化镁,故氯化钠、氯化镁、氯化铝三种溶液的pH值由大到小,故D错误.
故选B.
本题解析:
本题难度:简单
3、选择题 根据陈述的知识,类推得出的结论正确的是
A.HCl的水溶液显酸性,则NH3的水溶液也显酸性
B.常温下铝投入浓硫酸、浓硝酸中都没有气泡产生,则常温下铝投入浓盐酸中也没有气泡产生
C.常温下钠易与水反应,则常温下钾也易与水反应
D.无色的苯将橙色的溴水萃取后呈橙红色,则无色的苯将黄色的碘水萃取后呈棕黄色
参考答案:C
本题解析:A错,NH3是唯一呈碱性的气体,溶于水,水溶液俗称氨水溶液呈碱性;B错,常温铝投入浓硫酸、浓硝酸中没有气泡产生的原因是发生了钝化(即表面生成了致密而薄的氧化物薄膜),阻碍了反应的进一步进行,但浓HCL不会使铝发生钝化,常温会反应生成氯化铝和氢气。C对,钠、钾都是碱金属,化学性质相似,且钾的金属性比钠强更易与水发生剧烈的反应。D错,溴的苯溶液呈橙红色,但碘的苯溶液呈紫红色。
本题难度:一般
4、选择题 A、B、C均为短周期元素,它们在周期表中的位置如图。已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是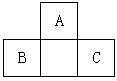
[? ]
A.Be、Na、Al
B.B、Mg、Si
C.O、P、Cl
D.C、Al、P
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列物质既能跟浓H2SO4反应,又能与烧碱反应的是
①MgCl2?②NaHCO3?③(NH4)2 S ?④Al(OH)3
A.只有④
B.除①外
C.除①③
D.全部都可以
参考答案:D
本题解析:氯化镁和浓硫酸反应可以制备氯化氢,另外氯化镁与和烧碱反应生成氢氧化镁白色沉淀。同样分析可知,其余选项都能和浓硫酸以及烧碱反应,答案选D。
点评:该题是中等难度的试题,也是高考中的重要考点。试题综合性强,侧重对基础性知识的巩固与检验,难度不大。该题的关键是记住常见物质的化学性质,然后灵活运用即可。
本题难度:简单