时间:2017-08-06 08:54:59
1、选择题 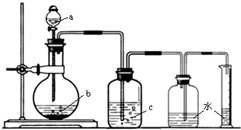 图是制取、洗涤并测量生成气体体积的装置示意图.利用上述装置进行下表所列实验,能达到试验目的是
图是制取、洗涤并测量生成气体体积的装置示意图.利用上述装置进行下表所列实验,能达到试验目的是
A.①
B.②
C.③
D.④
参考答案:A
本题解析:分析:由装置图可以看出,反应为固体和液体在不加热的条件下反应生成气体的装置,生成气体可用浓硫酸干燥并能用排水法收集,以此解答该题.
解答:A.氢气可用浓硫酸干燥,并能用排水法收集,故A正确;
B.氯气微溶于水,不能用排水大收集,故B错误;
C.二氧化碳微溶于水,不能用排水法收集,故C错误;
D.氨气不能用浓硫酸干燥,也不能用排水法收集,故D错误.
故选A.
点评:本题考查气体的制备、收集,题目难度不大,注意把握气体的制备装置图,判断气体可能具有的性质.
本题难度:一般
2、选择题 某学生运用将一粒金属钠和一块铜片分别放在表面皿中,研究它们在空气中的稳定性。该学生采用的研究方法有? ①假说法 ? ②实验法? ③分类法 ④比较法
A.①②
B.①③
C.②④
D.①③
参考答案:C
本题解析:该学生通过将两金属做对比实验,故答案为C
本题难度:一般
3、填空题 (4分)(1)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O。当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为 。
(2)氨气的制备与运输过程中都有严格要求。运输时,严禁与卤素(如Cl2)混装运输。若二者接触时剧烈反应产生白烟,若0.4 mol NH3参加反应时有0.3 mol 电子转移,写出反应的化学方程式____ 。
参考答案:(每空2分,共4分)(1)0.4 mol (2)8NH3 + 3Cl2 = N2 + 6 NH4Cl
本题解析:(1)在反应:As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O中,每产生2mol的H3AsO4,转移电子的物质的量是10mol,当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为2mol÷10×2=0.4mol。(2)根据题意可得方程式为:8NH3 + 3Cl2 = N2 + 6 NH4Cl。
考点:考查氧化还原反应方程式的书写及计算的知识。
本题难度:一般
4、选择题 向含有FeCl3、BaCl2的酸性溶液中通入SO2气体会有沉淀产生,该沉淀是
A.BaSO4
B.FeS
C.BaSO3
D.S
参考答案:A
本题解析:铁离子具有氧化性,能把SO2氧化生成硫酸,进而生成白色沉淀硫酸钡,答案选A。
考点:考查物质的化学性质
点评:该题属于基础性试题,难度不大,关键是记住常见物质的化学性质。
本题难度:一般
5、选择题 固体A的化学式为NH5,能跟水反应,它的所有原子的电子层结构都跟与该原子同周期的稀有气体原子一样,则下列说法中,不正确的是( )
A.1molNH5中有5NA个N—H键(NA为阿伏加德罗常数)
B.NH5中既有共价键、又有离子键,是离子晶体
C.NH5跟水的反应是氧化还原反应
D.NH5跟水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑
参考答案:A
本题解析:A、1molNH5中E有4mol的共价键和1mol的离子键,错误。
考点:考查氢化铵的结构。
本题难度:一般