时间:2017-08-01 02:37:10
1、填空题 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g)+2H2(g)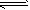 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g)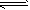 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应I在不同温度下的化学平衡常数(K)。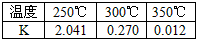
由表中数据判断ΔH1______0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,5min后该反应达到平衡,测得c(CO)=0.2
mol/L,则用H2表示的该反应的反应速率为:________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) =2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) =2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) =H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________________
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。 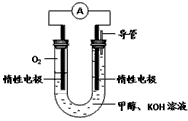
①该电池正极的电极反应为__________________。
②用该电池电解200mL饱和食盐水(溶质足量),一段时间后,阴极得标况下气体2.24L,电解后溶液的pH为________(溶液体积变化忽略不计),要使电解后溶液复原,所加物质为___________(填名称)。
参考答案:(1)①<;②0.32mol·L-1·min-1;250℃
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=-442.8 kJ∕mol
(3)①O2 + 2H2O + 4e-==4OH- ;②14;氯化氢
本题解析:
本题难度:一般
2、填空题 已知下列热化学方程式:
(1)Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g) ΔH=-25kJ·mol-1
(2)3Fe2O3(s)+CO(g)====2Fe3O4(s)+CO2(g) ΔH=-47kJ·mol-1
(3)Fe3O4(s)+CO(g) ====3FeO(s)+CO2(g) ΔH= +19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式:_________________________________。
参考答案:FeO(s)+CO(g)==Fe(s)+CO2(g) ΔH=-11kJ·mol-1
本题解析:
本题难度:一般
3、简答题 近年来,碳和碳的化合物在生产生活实际中应用广泛.
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活.
已知①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ?mol-1
则反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H=______.
(2)若用石墨做电极电解500ml饱和食盐水,写出电解反应的离子方程式为:______,电解一段时间后两极共收集到标准状况下的气体1.12L(不考虑气体的溶解).停止通电,假设反应前后溶液体积不变,则所得溶液的pH=______.
(3)0.10mol/L硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=______mol?L-1(Ksp[Cu(OH)2]=2.2×10-20).
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min H2O CO CO2 CO 1 650 2 4 1.6 2.4 5 2 900 1 2 0.4 1.6 3 3 900 a b c d t | ||
参考答案:(1)①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ?mol-1
依据盖斯定律计算,①+②得到,2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)△H=-1780.6KJ/mol;
热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ?mol-1;
故答案为:-890.3kJ?mol-1;
(2)电解饱和食盐水阳极是氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,反应的离子方程式为:2Cl-+2H2O 通电.H2↑+Cl2↑+2OH-; 电解一段时间后两极共收集到标准状况下的气体1.12L,物质的量为0.05mol,依据离子方程式计算得到生成氢氧根离子物质的量为0.05mol,c(OH-)=0.05mol0.5L=0.1mol/L;氢离子浓度为10-13mol/L,pH=13,
故答案为:2Cl-+2H2O通电.H2↑+Cl2↑+2OH-;13;
(3)当溶液的pH=8时,c(H+)=10-8mol/L,c(OH-)=10-6mol/L,Ksp[Cu(OH)2]=c(Cu2+)×c2(OH-)=2.2×10-20,c(Cu2+)=2.2×10-8mol/L,
故答案为:2.2×10-8;
(4)①实验1中 CO(g)+H2O(g)?CO2(g)+H2(g),
起始量(mol/L) 2 1 0 0
变化量(mol/L)0.80.8 0.8 0.8
平衡量(mol/L)1.20.20.8 0.8
以υ(H2) 表示的反应速率=0.8mol/L5min=0.16mol/L?min,
故答案为:0.16mol/(L?min);
②实验2条件下平衡常数,需要列式计算平衡浓度;
H2O(g)+CO(g)?CO2(g)+H2(g)
初始浓度 0.5mol/L 1mol/L 0 0
转化浓度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡浓度 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=c(CO2)c(H2)c(H2O)c(CO)=0.2×0.20.3×0.8=0.17,
故答案为:0.17;
③实验1中CO的转化率为1.6mol4mol×100%=40%,实验2中CO的转化率为0.4mol2mol×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,
故答案为:放;
④反应前后气体体积不变,达到相同平衡状态满足起始量之比相同即b=2a,故答案为:b=2a.
本题解析:
本题难度:一般
4、选择题 在常温常压下,已知:
4Fe(s)+3O2(g)=2Fe2O3(s) △H1
4Al(s)+3O2(g)=2Al2O3(s) △H2
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △H3
则△H3与△H1和AH2间的关系正确的是
[? ]
A.△H3=1/2(△H1+△H2)
B.△H3=△H2 -△H1
C.△H3 =2(△H2+△Hl)
D.△H3=1/2(△H2-△H1)
参考答案:D
本题解析:
本题难度:一般
5、选择题 已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)=CO2(g) △H=-393.51kJ·mol-1
C(金刚石)+O2(g)=CO2(g) △H=-395.41 kJ·mol-1
据此判断,下列说法中正确的是
[? ]
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
参考答案:A
本题解析:
本题难度:一般