时间:2017-08-01 02:31:00
1、选择题 下列说法正确的是(? )
A.需要加热的化学反应都是吸热反应
B.CO2分子内含有极性键,所以CO2分子是极性分子
C.同分异构体之间的转化属于物理变化
D.1mol二氧化硅晶体中含Si-O键为4mol
2、填空题 (11分)A、B、C、D、E、F六种短周期元素的原子序数依次增大。A是宇宙中含量最丰元素,B元素的原子价电子排布为nsnnpn,D元素的最外层电子数是其电子层数的3倍,F的最高价氧化物对应水化物有两性,能溶于C、E的最高价氧化物对应水化物中。试回答
(1)写出C原子的价层电子轨道表示式: ;D原子的价层电子排布式:___________,E的原子结构示意图:___________;
(2)B位于元素周期表的第?族,A、B形成原子个数比1:1且直线形分子的结构式: ;
(3)C的基态原子核外有 种不同运动状态的电子;
(4)E单质在空气中燃烧生成物的电子式: ,其中的阳离子与阴离子的个数比是 ;
(5)F的固态氧化物的用途有________ ___(说出一种)。F的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是? ?。
3、选择题 下列各项中表达正确的是
[? ]
A.F-的结构示意图: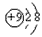
B.CO2的分子模型示意图:
C.NaCl的电子式:
D.N2的结构式: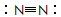
4、填空题 自然界中往往存在许多有趣也十分有意义的现象,下表列出了若干化合物的结构式、分子式、相对分子质量和沸点。 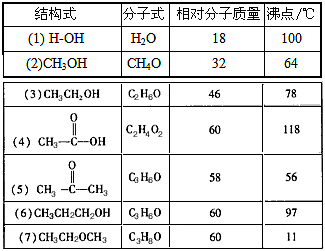
由表中物质的沸点可以得出什么结论?
_________________________________________
5、填空题 (5分)用VSEPR模型和杂化轨道理论相关知识填表:
| 分子或离子 | 孤对电子对数 | VSEPR模型名称 | 中心原子杂化轨道类型 | 分子或离子的立体构型名称 |
| CH4 | 0 | 正四面体形 | sp3 | 正四面体形 |
| BeCl2 | ? | ? | ? | ? |
| SO2 | ? | ? | ? | ? |
| CH3+ | ? | ? | ? | ? |
| SO42- | ? | ? | ? | ? |
| NCl3 | ? | ? | ? | ? |