时间:2017-08-01 02:30:17
1、选择题 下列比较中正确的是
[? ]
A.同温和同物质的量浓度时,HF比HCN易电离,则溶液pH:NaF>NaCN
B.物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.2 mol/L NH4Cl和0.1 mol/L NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
D.将①pH=2的CH3COOH溶液②pH=2的盐酸③pH=12的氨水④pH=12的NaOH溶液稀释相同倍数后溶液的pH:③>④>①>②
参考答案:B
本题解析:
本题难度:一般
2、选择题 下面的说法正确的是(?)
A.硫酸钡不溶于水,所以硫酸钡是非电解质
B.二氧化碳溶于水可以导电,所以二氧化碳是电解质
C.固态磷酸是电解质,所以磷酸在熔融时或溶于水时都能导电
D.液态氯化氢不能导电,但氯化氢是电解质
参考答案:D
本题解析:硫酸钡不溶于水但受热熔化时刻导电,故硫酸钡是电解质,所以A错误;虽然二氧化碳溶于水可以导电,但在水溶液中能直接电离出自由移动的离子不是二氧化碳,而是碳酸,故B项错误;C项中磷酸在熔融时不能导电,故该项错误。
本题难度:简单
3、填空题 在用Na2SO3溶液吸收SO2QUOTE o2的过程中,pH随n(SO32-)::n(HSO32-)变化关系如下表:
n(SO32-):n(HSO3-)
91:9
1:1
1:91
PH
8.2
7.2
6.2
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:______
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):______
a.c(Na+)=2c(SO
参考答案:①在溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据表格知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性,亚硫酸氢根离子既能水解又能电离,亚硫酸氢钠溶液呈酸性同时说明HSO3-的电离程度大于水解程度,
故答案为:酸性;HSO3-存在HSO3-?H++SO32- 和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度;
②当溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度.
a溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,所以c(Na+)=2c(SO32-)+c(HSO3-),故正确.
b溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故正确.
c溶液呈电中性,溶液中阴阳离子所带电荷相等,得c(Na+)+c(H-)=2c(SO32-)+c(HSO3-)+c(OH-),故错误.
故选ab.
本题解析:
本题难度:一般
4、选择题 25℃时,有关弱酸的电离平衡常数如下: 
下列有关说法正确的是
[? ]
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
B.amol/LHCN溶液与bmol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
参考答案:D
本题解析:
本题难度:一般
5、选择题 在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol ·L-1CH3COOH溶液,溶液pH变化曲线 如图所示,列有关离子浓度的比较正确的是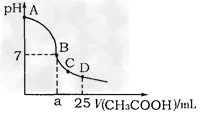
[? ]
A.在A、B间任一点(不含A、B点),溶液中可能?有c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
参考答案:A
本题解析:
本题难度:一般