时间:2017-08-01 02:22:42
1、填空题 物质在下列变化过程中克服的是:①共价键?②离子键.(填序号)
(1)HCl溶于水______(2)电解熔融NaCl制Na______(3)电解水分解生成O2和H2______.
参考答案:(1)HCl中存在的化学键是共价键,所以溶于水时,破坏的是共价键,故答案为:共价键;
(2)NaCl中存在的化学键是离子键,所以电解熔融的氯化钠时,破坏的是离子键,故答案为:离子键;
(3)水中存在的化学键都是共价键,所以破坏的是共价键,故答案为:共价键.
本题解析:
本题难度:一般
2、选择题 用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是
A.若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C.反应①②转移的电子数相同
D.反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
参考答案:D
本题解析:A.①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ;ΔH=-574 kJ?mol-1 ②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160 kJ?mol-1 ①+②:2CH4(g)+4NO2 (g)=2N2(g)+2CO2(g)+4H2O(g) ΔH=-1160+(-574)=" -1734" kJ?mol-1标准状况下4.48 L CH4的物质的量为0.1mol,放出热量173.4 kJ ,A正确;B.气态水转化为液态水是放热的过程,反应中生成的水为液体,放出热量更多,ΔH更小,ΔH<-574 kJ·mol-1,B正确;C.反应①②转移的电子数均为8,C正确;D. 4.48 L CH4没有标明状态,无法计算体积,D错误;选D。
考点:考查用盖斯定律进行有关反应热的计算。
本题难度:一般
3、选择题 下列化学反应属于吸热反应的是(?)
A.盐酸与烧碱溶液反应
B.Ba(OH)2·8H2O+2NH4Cl BaCl2+2NH3↑+10H2O
BaCl2+2NH3↑+10H2O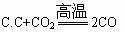
D.葡萄糖在人体内氧化分解
参考答案:BC
本题解析:酸碱中和都属于放热反应;葡萄糖在人体内氧化分解为人的生命活动提供能量,也属于放热反应;C与CO2反应需持续加热,属于吸热反应。
本题难度:一般
4、选择题 下列分子中,既含有σ键又含有π键的是(?)
A.CH4
B.N2
C.HCl
D.F2
参考答案:B
本题解析:A、CH4,不含有σ键和π键,故错;C、HCl是S轨道与P轨道形成σ键,不含π键,故错;D、F2是由两个P轨道形成σ键,不含π键,故错。故选B。
点评:本题考查的是共价键——σ键和π键的相关知识,题目难度不大,注意基础知识的学习。
本题难度:简单
5、填空题 (4分)合成氨工业的核心反应是N2(g)+3H2(g)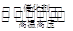 2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题。
2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题。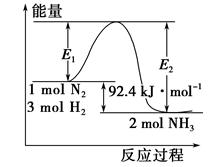
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化:E1________,E2________(填“增大”、“减小”或“不变”)。
(2)在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量________(填“<”、“>”或“=”)46.2 kJ,理由是____________________________________________________________。
参考答案:(1) E1减小,E2减小。(2)< 因为该反应是可逆反应,反应不会进行到底
本题解析:(1)加入催化剂,降低了反应的活化能,即最高能量降低,所以E1和E2均减小;
(2)因为合成氨的反应是可逆反应,当0.5mol氮气与1.5mol氢气完全转化为氨气时才放出46.2kJ的热量,所以实际放出的热量要小于46.2kJ。
考点:考查催化剂的作用,对可逆反应的理解
本题难度:一般