时间:2017-08-01 02:18:42
1、选择题 在醋酸溶液中存在电离平衡CH3COOH?CH3COO-+H+,要使电离平衡向右移动且c(H+)增大,可采取的措施是( )
A.加NaOH(s)
B.加盐酸
C.升高温度
D.加蒸馏水
参考答案:A、加入氢氧化钠固体,氢氧化钠和氢离子反应生成水,能促进醋酸的电离,但氢离子浓度减小,故A错误;
B、加入盐酸能增大氢离子浓度但抑制醋酸的电离,故B错误;
C、醋酸的电离是吸热反应,升高温度能促进醋酸的电离,且氢离子浓度大,故C正确;
D、加蒸馏水能促进醋酸的电离,但氢离子浓度减小,故D错误;
故选C.
本题解析:
本题难度:简单
2、填空题 (15分)
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)H3PO2及NaH2PO2)均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①(H3PO2)中,磷元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4
参考答案:
本题解析:
本题难度:困难
3、选择题 已知亚磷酸(H3PO3)只能生成两种钠盐(NaH2PO3和Na2HPO3),由此可知不正确的说法是( )
A.亚磷酸中磷呈+3价
B.亚磷酸有氧化性和还原性
C.亚磷酸是三元酸
D.亚磷酸只形成两种酸式盐而无正盐
参考答案:A、H的化合价为+1、O的为-2,则H3PO3中P元素的化合价为0-(+1)×3-(-2)×3=+3,故A正确;
B、H3PO3中P元素的化合价为+3价,是中间价态,既能升高又能降低,则亚磷酸有氧化性和还原性,故B正确;
C、由信息可知,亚磷酸只能生成两种钠盐,则只有两个羟基氢,为二元酸,故C错误;
D、Na2HPO3为正盐,则亚磷酸可形成酸式盐和正盐,故D错误;
故选CD.
本题解析:
本题难度:简单
4、填空题 A、B、C、D是短周期元素形成的四种气体单质,其它物质为化合物。H常作为普通锌锰干电池的电解质。有关的转化关系如下图所示(反应条件均已略去)。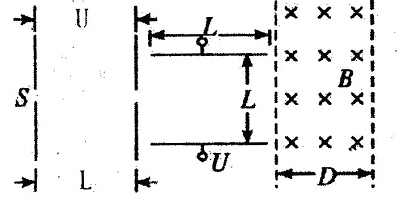
请回答下列问题:
(1)B的结构式为____?,G的化学式为?。
(2)Y和E在一定条件下可反应生成B和Z,该反应的化学方程式为?。
(3)在体积为0.5L的恒容密闭容器中,充人1.25molB和1.25molD进行如下化学反应:
B(g)+3D(g)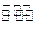 2Y(g),其化学平衡常数K与T的关系如下表所示:
2Y(g),其化学平衡常数K与T的关系如下表所示:
| T/℃ | 300 | 400 |
| K | 3.41 | 0.50 |
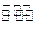 2Y(g)达到平衡状态,时间为t
2Y(g)达到平衡状态,时间为t 1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是(?)
1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是(?)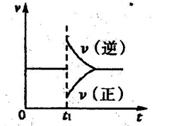
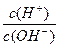 =l×10-8,下列叙述中错误的是?(?)
=l×10-8,下列叙述中错误的是?(?)参考答案:
本题解析:略
本题难度:一般
5、填空题 某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:
(1)当m=l时,测定0.1 mol/L HA的pH值,若测得0.1mol/L HA的pH=2,说明HA为__________酸(填“强”、“弱”)向此溶液中加入稀NaOH溶液,使其恰好完全反应,所得溶液pH_________7(填“>”“<”“=”),用离子方程式表示其原因__________.
(2)取少量NamA固体溶于蒸馏水,向所得溶液中滴加2滴石蕊试液,若溶液由无色变成蓝色,证明HmA是_______酸(填“强”、“弱”)。若某浓度的NamA溶液pH=9,则该溶液中水电离的c(OH-)=_________mol/L.
(3)室温下,将pH=2的酸HmA和pH=12的碱B(OH)n等体积混合,测得混合液的pH=10,若生成的正盐中只有一种离子能水解。则该离子水解的离子方程式为_________________________;若m、n都为1,所得混合液中各离子的物质的量浓度由大到小的顺序是____________。
(4)现有相同浓度的HA1、HA2两种溶液、蒸馏水、常见指示剂(如石蕊、酚酞)、pH试纸以及常用的实验仪器,有两位同学进行试验:一位同学取少量HA1溶液,滴加2滴石蕊试液,试液变红。微热,观察发现溶液红色加深,推断HA1为________ 酸(填“强”、“弱”)。另一位同学取少量HA2溶液,测定其pH。然后将溶液稀释100倍,再测其pH。对比两次测定的pH相差2,据此推断HA2为__________酸(填“强”、“弱”)。
参考答案:(1)弱?>? A—+H2O HA+OH—(2)弱? 1×10—5
HA+OH—(2)弱? 1×10—5
(3)Bn++nH2O B(OH)n+nH+?c(B+)>c(A-)>c(OH-)>c(H+)(4)弱 强
B(OH)n+nH+?c(B+)>c(A-)>c(OH-)>c(H+)(4)弱 强
本题解析:证明HmA为弱酸,可从以下角度判断:①看其在水溶液中的电离程度,若部分电离,则为弱酸;②看是否存在电离平衡,若存在电离平衡,则为弱酸;③测NamA溶液的酸碱性,若显碱性,则为弱酸;(1)当m=l时,测定0.1 mol/L HA的pH值,若测得0.1mol/L HA的pH=2,则HA部分电离,能说明HA是弱酸;向此溶液中加入稀NaOH溶液,使其恰好完全反应,所得溶液为NaA溶液,为强碱弱酸盐溶液,水解显碱性,pH>7,用离子方程式表示其原因A—+H2O HA+OH—;(2)取少量NamA固体溶于蒸馏水,向所得溶液中滴加2滴石蕊试液,若溶液由无色变成蓝色,说明NamA溶液显碱性,NamA为强碱弱酸盐水解显碱性,证明HmA是弱酸;若某浓度的NamA溶液pH=9,则溶液中c(H+)=1×10—9mol/L,c(OH-)=1×10—5mol/L,而溶液中H+和OH—均来自水的电离。则该溶液中水电离的c(OH-)=1×10—5mol/L;(3)室温下,将pH=2的酸HmA和pH=12的碱B(OH)n等体积混合,测得混合液的pH=10,显碱性,则二者反应碱过量,说明HmA为强酸,B(OH)n为弱碱;生成的正盐中只有Bn+能水解,水解的离子方程式为Bn++nH2O
HA+OH—;(2)取少量NamA固体溶于蒸馏水,向所得溶液中滴加2滴石蕊试液,若溶液由无色变成蓝色,说明NamA溶液显碱性,NamA为强碱弱酸盐水解显碱性,证明HmA是弱酸;若某浓度的NamA溶液pH=9,则溶液中c(H+)=1×10—9mol/L,c(OH-)=1×10—5mol/L,而溶液中H+和OH—均来自水的电离。则该溶液中水电离的c(OH-)=1×10—5mol/L;(3)室温下,将pH=2的酸HmA和pH=12的碱B(OH)n等体积混合,测得混合液的pH=10,显碱性,则二者反应碱过量,说明HmA为强酸,B(OH)n为弱碱;生成的正盐中只有Bn+能水解,水解的离子方程式为Bn++nH2O B(OH)n+nH+;若m、n都为1,所得混合液显碱性,则c(OH-)>c(H+),根据电荷守恒知,c(B+)>c(A-),各离子的物质的量浓度由大到小的顺序是c(B+)>c(A-)>c(OH-)>c(H+);(4)取少量HA1溶液,滴加2滴石蕊试液,试液变红。微热,观察发现溶液红色加深,说明HA1溶液中存在电离平衡,弱电解质的电离吸热,升温,促进电离,红色加深,推断HA1为弱酸;取少量HA2溶液,测定其pH,然后将溶液稀释100倍,再测其pH,对比两次测定的pH相差2,据此推断HA2为强酸。
B(OH)n+nH+;若m、n都为1,所得混合液显碱性,则c(OH-)>c(H+),根据电荷守恒知,c(B+)>c(A-),各离子的物质的量浓度由大到小的顺序是c(B+)>c(A-)>c(OH-)>c(H+);(4)取少量HA1溶液,滴加2滴石蕊试液,试液变红。微热,观察发现溶液红色加深,说明HA1溶液中存在电离平衡,弱电解质的电离吸热,升温,促进电离,红色加深,推断HA1为弱酸;取少量HA2溶液,测定其pH,然后将溶液稀释100倍,再测其pH,对比两次测定的pH相差2,据此推断HA2为强酸。
本题难度:一般