时间:2017-08-01 01:59:28
1、填空题 (7分)已知:A酸的溶液pH=a,B碱的溶液pH="b?"
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH=?。酸碱按体积比为1:10混合后溶液显中性,则a+b=?。
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为?mo1·L–l,B溶液中水电离出的氢离子浓度为?mol·L–1。
(3)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA ??VB,混合后溶液中的离子浓度关系为c(Na+)??c(CH3COO—)。?
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为??。
参考答案:(7分)(1)pH="?7?" ?。a+b="?13?" 。
(2)为?10—10? mo1·L–l,为?10—12?mol·L–1。(3)VA <? VB, c(Na+)=?c(CH3COO—)。
(4)离子方程式为?M++H2O MOH+H+
MOH+H+
本题解析:略
本题难度:一般
2、选择题 水的电离平衡曲线如图所示,下列说法不正确的是? ( )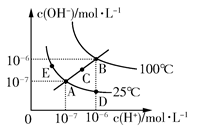
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH4Cl固体的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
参考答案:C
本题解析:水的离子积常数只与温度有关,图中A、D、E三点的KW相等,都是25℃时水的电离平衡状态;B点是100℃时水的电离平衡状态,水的电离程度最大,KW最大;C点的KW介于A点和B点之间。从A点到D点,c(OH-)减小,c(H+)增大,溶液显酸性,可以采用加入少量酸的方法。从A点到C点,c(OH-)和c(H+)都增大,且增大之后仍然有c(H+)=c(OH-),应是温度升高所致,加入NH4Cl固体后溶液显酸性,C项错误。在B点时,KW=10-12,pH=2的硫酸中,c(H+)=0.01 mol/L;pH=10的KOH溶液中c(OH-)=0.01 mol/L,二者等体积混合时恰好反应,溶液显中性。
本题难度:一般
3、选择题 把1 mL 0.1 mol·L-1的H2SO4加水稀释制成2 L溶液,在此溶液中由水电离产生的H+浓度接近于(?)
A.1×10-4mol·L-1
B.1×10-8mol·L-1
C.1×10-11mol·L-1
D.1×10-10mol·L-1
参考答案:D
本题解析:此题是水中加硫酸,水中c(H+)必然增大,而由于KW为一常数,c(OH-)必然减小,而c(OH-)只能来自水的电离,故只需求出c(OH-),便知道由水电离出的c(H+)。
c(H+)=1×10-4mol·L-1,则cH2O(OH-)=c总(OH-)= =1×10-10mol·L-1。
=1×10-10mol·L-1。
本题难度:简单
4、实验题 阅读下列实验内容,根据题目要求回答问题:
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14 mol·L-1NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)___________________________ ?。
②该滴定操作中应选用的指示剂是? ____________?。
③在G操作中如何确定终点?? __________________________? ____?。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果______________(填“偏小”、“偏大”或“无影响”)。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是? ___________?。
(4)如有1 mol·L-1和0.1 mol·L-1的NaOH溶液,应用________________? _的NaOH溶液,原因是__________________________? __________________________?。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入?__(选填“甲”或“乙”)中。
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值?(选填“偏大”“偏小”或“无影响”)
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果保留到小数点后第二位)? ___?。
参考答案:(1)①ECDBAGF(2分,其它合理答案也给分)②酚酞 ③溶液由无色变为浅红色(或粉红色)且半分钟内不褪色(2)偏大(3)100mL容量瓶(100未写不给分)
(4)0.1 mol·L-1?溶液浓度越稀,误差就越小
(5)乙(6)偏小(7)4.20mol·L-1(2分,单位不写扣1分)
本题解析:(1)用标准0.14 mol·L-1NaOH溶液滴定硫酸,首先要检查滴定管是否漏水,再用蒸馏水洗干净滴定管,取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下,然后用待测定的溶液润洗酸式滴定管,再用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂,把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度;另取锥形瓶,再重复操作一次,故①滴定操作的正确顺序为ECDBAGF;②该滴定实验是用标准0.14 mol·L-1NaOH溶液滴定硫酸,所以要用酚酞作为终点的指示剂;③当溶液由无色变为浅红色(或粉红色)且半分钟内不褪色,即可以认为滴定达到终点;(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗,说明NaOH溶液的浓度小于0.14mol·L-1,所以会使计算的结果变大;(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是100mL容量瓶;(4)如有1 mol·L-1和0.1 mol·L-1的NaOH溶液,应用0.1 mol·L-1的NaOH溶液,因为溶液浓度越稀,误差就越小;(5)甲为酸式滴定管,乙为碱式滴定管,故用标准NaOH溶液滴定时,应将标准NaOH溶液注入乙中;(6)观察碱式滴定管读数时,若滴定前仰视,则读到的数值比实际数值大,滴定后俯视,则读到的数值比实际数值小,所以最后计算时得到的氢氧化钠的体积比实际上的小,故导致测得的稀H2SO4溶液浓度测定值偏小;(7)根据c1v1=c2v2,可以得到0.14×15=2×c2×25,所以c2=0.042mol/L,故待测硫酸(稀释前的硫酸)溶液的物质的量浓度为0.042×100=4.2mol/L。
点评:本题考查酸碱滴定,酸碱滴定是中学的经典实验之一,是高考常考的考点,本题难度不大。
本题难度:一般
5、实验题 (12分)某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
⑴盛装0.2000 mol/L盐酸标准液应该用?式滴定管。
⑵滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视__?,直到因加入一滴盐酸后,溶液由黄色变为橙色,并?为止。
⑶滴定操作可分解为如下几步:
①检查滴定管是否漏水
②取一定体积的待测液于锥形瓶中
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管?
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器
⑥滴定操作
正确的操作顺序为:?。
⑷有关数据记录如下:
| 实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.20 |
参考答案:⑴酸(1分)?⑵锥形瓶内溶液颜色的变化,半分钟内无颜色变化?(2分)
⑶①⑤③④②⑥?(2分)?⑷0.2000 (3分)?⑸无影响(2分)偏低(2分)
本题解析:(1)盐酸显酸性,用酸式滴定管盛装。
(2)中和滴定时,必须要准确判断滴定终点,所以眼睛要始终注视锥形瓶内溶液颜色的变化。终点的判断标准时溶液的颜色在半分钟内无颜色变化。
(3)考查中和滴定的实验操作,正确的顺序是①⑤③④②⑥。
(4)3次实验消耗盐酸的体积分别是20.20ml、20.00ml、19.80ml,所以消耗盐酸体积的平均值为20.00ml,因此氢氧化钠溶液的浓度是0.2000 mol/L。
(5)锥形瓶不能标准液润洗,所以不影响。滴定终点时俯视读数,则读数偏小,因此消耗盐酸的体积就偏小,所以测定结果偏低。
本题难度:一般