时间:2017-08-01 01:58:44
1、选择题 常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 00 mol·L-1 CH3COOH溶液滴定曲线如图所示。下列说法正确的是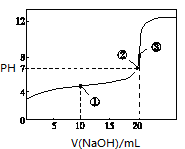
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
参考答案:D
本题解析:A、根据电荷守恒有c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
B、②点不是滴定终点,c(Na+)=c(OH-)+c(CH3COO-)
C、③为滴定终点,水解呈碱性,c(Na+)> c(CH3COO-)> c(OH-)>c(H+)
本题难度:一般
2、选择题 今有室温下四种溶液,有关叙述不正确的是( )
| ? | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
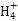 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)参考答案:C
本题解析:①、②中分别加入适量的氯化铵晶体后,因为铵根离子要结合氢氧根离子,溶液的碱性减弱,两溶液的pH均减小,A正确;分别加水稀释10倍,氢氧化钠pH减小1,盐酸pH增大1,氨水减小的比1小,醋酸增大的比1小,所以①>②>④>③,B正确;①、④两溶液等体积混合,由于氨水的浓度远大于盐酸的浓度,故氨水过量,溶液显碱性,因此有:c(N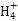 )>c(Cl-)>c(OH-)>c(H+),C错误;Va L④与Vb L ②溶液混合,若混合后溶液pH=4,
)>c(Cl-)>c(OH-)>c(H+),C错误;Va L④与Vb L ②溶液混合,若混合后溶液pH=4,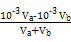 =10-4,则Va∶Vb=11∶9,D正确。
=10-4,则Va∶Vb=11∶9,D正确。
本题难度:一般
3、选择题 下列有关反应热的说法中正确的是?(?)
A.不同的化学反应具有不同的反应热
B.中和热△H=" -" 57.3kJ·mol-1,所以1.00L 1.00mol·L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量
C.用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大
D.在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热
参考答案:A
本题解析:中和热是在一定条件下,酸和碱在稀溶液中生成1mol水时所发出的热量。选项B中生成的是2mol水,所以发出的热量是2×57.3kJ,即B不正确;选项C中生成的水是相同的,所以测得的值不会发生变化,选项C不正确;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时,所放出的热量。水的稳定状态是液态,所以选项D不正确,答案选A。
本题难度:一般
4、选择题 碳酸(H2CO3)是二元弱酸,碳酸氢钾溶液呈碱性。在0.1mol/LKHCO3溶液中,下列关系正确的是(?)
A.c(K+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
B.c(HCO3-)+c(CO32-)="0.1" mol/L
C.c(CO32-)>c(H2CO3)
D.c(K+)+ c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
参考答案:D
本题解析:略
本题难度:简单
5、选择题 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合溶液的pH=5,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出的c(H+) =1×10-5 mol/L
B.c(A-) + c(HA) ="2c" (Na+) = 0.4 mol/L
C.HA溶液中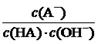 与上述混合溶液中
与上述混合溶液中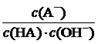 相等
相等
D.c(A-)-c(HA)? =" 2" c (OH-)-2c (H+)
参考答案:C
本题解析:根据题意知,室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合,所得溶液为0.1mol/L HA和0.1mol/L NaA的混合液,混合溶液的pH=5,则HA为弱酸,混合液中HA的电离程度大于NaA的水解程度。A、混合溶液中由水电离出的c(H+) =1×10-9 mol/L,错误;B、根据混合液中的物料守恒知,c(A-) + c(HA) ="2c" (Na+) = 0.2mol/L,错误;C、根据HA的电离常数表达式及水的离子积常数
表达式知,溶液中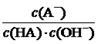 ="Ka(HA)/Kw" ,上述反应过程中,温度不变,Ka(HA)、Kw不变,故HA溶液中
="Ka(HA)/Kw" ,上述反应过程中,温度不变,Ka(HA)、Kw不变,故HA溶液中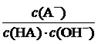 与上述混合溶液中
与上述混合溶液中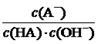 相等,正确;D、根据混合液中的物料守恒和电荷守恒式知,c(A-)-c(HA)? ="2c" (H+)— 2 c (OH-),错误。
相等,正确;D、根据混合液中的物料守恒和电荷守恒式知,c(A-)-c(HA)? ="2c" (H+)— 2 c (OH-),错误。
本题难度:一般