时间:2017-08-01 01:52:35
1、选择题 有下列有机反应类型:
①消去反应 ②水解反应 ③加聚反应 ④加成反应 ⑤还原反应 ⑥氧化反应
以丙醛为原料制取1,2丙二醇,涉及的反应类型依次是( )
A.⑥④②①
B.⑤①④②
C.①③②⑤
D.⑤②④①
参考答案:B
本题解析:
本题难度:一般
2、选择题 常温下,有关下列4种溶液的说法正确的是
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
参考答案:D
本题解析:A、盐酸是强酸,氨水是弱碱,因此在浓度相同的条件下,盐酸对水的电离抑制程度大,即由水电离出的c(H+):③<①,A不正确;B、氨水是弱碱,0.1 mol·L-1氨水稀释到原来的100倍浓度是0.001mol/L,其溶液的pH值小于11,B不正确;C、①与③混合,若溶液pH=7,则根据电荷守恒可知溶液中c(NH4+)=c(Cl-),C不正确;D、②与④等体积混合后氨水过量溶液显碱性,因此混合液pH>7,D正确,答案选D。
考点:考查弱电解质的电离、溶液中离子浓度大小比较以及pH计算
本题难度:一般
3、选择题 向体积为Va的0.05 mol/L CH3COOH溶液中加入体积为Vb的0.05 mol/L KOH溶液,下列关系错误的是 ( )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
参考答案:C
本题解析:若醋酸与氢氧化钾等体积混合,两者恰好完全反应生成醋酸钠和水;此时溶液中粒子关系为,电荷守恒:c(K+)+c(H+)=c(OH-)+c(CH3COO-),质量守恒:c(CH3COOH)+c(CH3COO-)=c(K+),质子守恒:c(OH-)= c(H+) +c(CH3COOH);所以
A正确,Va>Vb时:醋酸过量,即有c(CH3COOH)+c(CH3COO-)>c(K+);B正确,Va=Vb时:由质子守恒得c(CH3COOH)+c(H+)=c(OH-);C错,Va<Vb时:KOH过量,c(K+)>c(CH3COO-)>c(OH-)>c(H+);D正确,由电荷守恒可得,任意溶液中c(K+)+c(H+)=c(OH-)+c(CH3COO-);
本题难度:困难
4、填空题 (7分)(1)常温下,已知0.1 mol·L—1一元酸HA溶液中c(OH-)/c(H+)=1×10—8,则溶液的pH=_____________。
①pH=3的HA与pH=l1的NaOH溶液等体积混合;反应的离子方程式为______________;混合溶液中,各离子的物质的量浓度大小关系是____________;
②0.2 mol·L—1HA溶液与0.1 mol·L—1NaOH溶液等体积混合后所得溶液中(溶液体积变化忽略不计):c(H+)+ c(HA)— c(OH-)=" ____________" mol·L—1。
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=___________。
①该温度下(t℃),将100mL0.1 mol·L—1的稀H2SO4与100mL0.4 mol·L—1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___________;
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是_______________。
参考答案:(1)3 ①HA+H+ A—+H2O; c(A—)>c(Na+) >c(H+) >c(OH-);②0.05 mol·L—1。
A—+H2O; c(A—)>c(Na+) >c(H+) >c(OH-);②0.05 mol·L—1。
(2)1×10—13。①12;②pHa+pHb=12。
本题解析:(1)常温下,已知0.1 mol·L—1一元酸HA溶液中c(OH-)/c(H+)=1×10—8,而Kw= c(OH-)·c(H+)=1×10—14,c(H+)=1×10—,3则溶液的pH=3。①0.1 mol·L—1一元酸HA溶液的pH=3则HA为弱酸,pH=3的HA与pH=l1的NaOH溶液等体积混合反应的离子方程式为HA+H+ A—+H2O;HA远过量,混合溶液为HA和NaA的混合液,溶液呈酸性,各离子的物质的量浓度大小关系是c(A—)>c(Na+) >c(H+) >c(OH-);②0.2 mol·L—1HA溶液与0.1 mol·L—1NaOH溶液等体积混合后所得溶液为浓度均为0.05 mol·L—1的HA和NaA的混合液,物料守恒为:c(HA)+ c(A—)=" 0.1" mol·L—1,电荷守恒式为c(H+)+ c(Na+)= c(A—)+ c(OH-),c(Na+)=" 0.05" mol·L—1则c(H+)+ c(HA)— c(OH-)=" 0.05" mol·L—1。(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,硫酸中氢离子浓度和氢氧化钠溶液氢氧根离子浓度相等,均为10—2 mol·L—1,又氢氧化钠溶液中氢离子浓度为10—11 mol·L—1,则该温度下水的离子积常数Kw=1×10—13。①该温度下(t℃),将100mL0.1 mol·L—1的稀H2SO4与100mL0.4 mol·L—1的NaOH溶液混合后氢氧化钠过量,混合液中c(OH-)=(100mL×0.4 mol·L—1—100mL×0.2 mol·L—1)÷200mL="0.1" mol·L—1,c(H+)=" Kw" / c(OH-) =10—12 mol·L—1,溶液的pH=12;②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则10—pHa=10×10 pHb—13,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是pHa+pHb=12。
A—+H2O;HA远过量,混合溶液为HA和NaA的混合液,溶液呈酸性,各离子的物质的量浓度大小关系是c(A—)>c(Na+) >c(H+) >c(OH-);②0.2 mol·L—1HA溶液与0.1 mol·L—1NaOH溶液等体积混合后所得溶液为浓度均为0.05 mol·L—1的HA和NaA的混合液,物料守恒为:c(HA)+ c(A—)=" 0.1" mol·L—1,电荷守恒式为c(H+)+ c(Na+)= c(A—)+ c(OH-),c(Na+)=" 0.05" mol·L—1则c(H+)+ c(HA)— c(OH-)=" 0.05" mol·L—1。(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,硫酸中氢离子浓度和氢氧化钠溶液氢氧根离子浓度相等,均为10—2 mol·L—1,又氢氧化钠溶液中氢离子浓度为10—11 mol·L—1,则该温度下水的离子积常数Kw=1×10—13。①该温度下(t℃),将100mL0.1 mol·L—1的稀H2SO4与100mL0.4 mol·L—1的NaOH溶液混合后氢氧化钠过量,混合液中c(OH-)=(100mL×0.4 mol·L—1—100mL×0.2 mol·L—1)÷200mL="0.1" mol·L—1,c(H+)=" Kw" / c(OH-) =10—12 mol·L—1,溶液的pH=12;②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则10—pHa=10×10 pHb—13,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是pHa+pHb=12。
考点:考查水的电离和溶液的酸碱性。
本题难度:困难
5、填空题 (7分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,
用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题: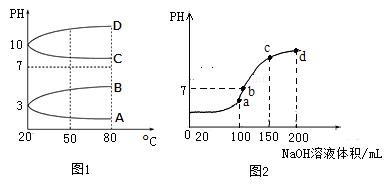
(1)相同条件下,相等物质的量浓度的NH4Al(SO4)2中c(NH4+) (填“=”、“>”“<”)NH4HSO4中c(NH4+)。
(2)如图1是0.1mol?L
参考答案:
本题解析:
本题难度:困难