时间:2017-08-01 01:46:21
1、选择题 下列说法正确的是
A.往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2
B.在食醋总酸含量的测定中,没有控制好滴定终点,溶液显深红色,则必须重做实验
C.阿司匹林具有抑制血小板凝聚作用,可用于治疗心血管疾病,因其具有较强的酸性,常制成阿司匹林肠溶片
D.摩尔盐的制备实验中,将FeSO4和(NH4)2SO4混合液在蒸发皿中蒸发至有大量晶体析出,抽滤,并用少量酒精洗去晶体表面的水分
参考答案:C
本题解析:过量氯水会氧化I2生成HIO3,故A错误;在食醋总酸含量的测 定中,没有控制好滴定终点,溶液显深红色,这时可以反滴,反滴至指示剂刚好变色,然后重新计算两种溶液的用量,故B错误;C正确;将(NH4)2SO4饱和溶液与FeSO4饱和溶液混合后,在蒸发皿中蒸发至大量晶体析出,然后冷却、抽滤得到结晶水合物,缺少冷却这个步骤,故D错误。
本题难度:简单
2、选择题 下图所示的实验装置不能够达到实验目的的是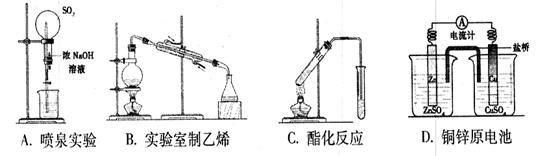
参考答案:B
本题解析:SO2可以和NaOH反应,因而可被NaOH溶液吸收,利用这一原理可做喷泉实验,A正确;实验室制乙烯一般用乙醇和浓硫酸反应,需要控制温度在170℃左右,但B装置中没有温度计,无法控制温度,B错;羧酸和醇在浓硫酸作催化剂,加热的条件下可生成酯,C正确;铜、锌原电池可设计成用盐桥相连的两个半电池,D正确。
本题难度:一般
3、选择题 若实验室制取的二氧化碳中含有少量的氯化氢气体,除去氯化氢最适宜的物质是( )
A.氨水
B.碳酸钠饱和溶液
C.浓硫酸
D.碳酸氢钠饱和溶液
参考答案:D
本题解析:略
本题难度:一般
4、实验题 氧化铁是重要工业颜料。工业上通常以废铁屑(杂质不与酸反应)为原料制备FeCO3,再将其煅烧制取氧化铁。工业制备FeCO3的流程如下:
回答下列问题:
(1)操作Ⅰ的名称是?。
(2)写出生成FeCO3沉淀的离子方程式?。
(3)有些同学认为滤液Ⅰ中铁元素含量可用KMnO4溶液来测定(5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需?。
②某同学设计了下列滴定方式(夹持部分略去),最合理的是?。(填字母序号)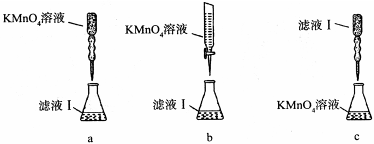
(4)该流程中用到的Na2CO3在工业生产中常含有少量NaCl。某校化学活动社团设计如图所示装置来测定Na2CO3的含量。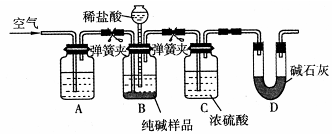
①要检验Na2CO3中杂质的存在,选用下列试剂中的?(选填序号)。
a.氢氧化钡溶液? b.稀硝酸? c.硫氰酸钾溶液? d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后静置,若?,说明装置不漏气。
③装置A中的试剂?,装置C的作用?。
④以上实验装置存在明显缺陷,该缺陷导致测定结果偏高,该缺陷为?。
参考答案:(14分)
(1)过滤(2分)
(2)Fe2+ +HCO- 3 = FeCO 3↓+ CO2 +H2O ( 2分)
(3)①250mL容量瓶(1分) ②b(1分)
(4)①bd(2分)
②漏斗中与试剂瓶中的液面差不再变化或漏斗中的液面不再下降(2分)
③NaOH溶液(1分) 干燥(1分)(其他合理答案均得分)
④在BC之间缺少吸收HCl的装置、在D装置后缺少盛有碱石灰的干燥管(答对其中1个得2分,其他合理答案均得分)
本题解析:
(1)固液分离采取过滤操作。
(2)由题意分析Fe2+ +HCO- 3 = FeCO 3↓+ CO2 +H2O符合题意。
(3)①配置一定物质的量浓度溶液需要容量瓶,容量为250mL。②Fe2+、KMnO4溶液均为酸性且KMnO4溶液强氧化性,使用酸式滴定管。
(4)
①Na2CO3中含有少量NaCl检验用稀硝酸酸化的硝酸银溶液;
②检测气密性,就是利用压强差,漏斗中与试剂瓶中的液面差不再变化或漏斗中的液面不再下降均可;
③用NaOH溶液吸收空气中二氧化碳,防止产生干扰;用浓硫酸除去气体中水分。
④可见BC之间缺少除去HCl的装置,而且大气中成分也会进入D。
本题难度:困难
5、选择题 下列说法中,正确的是(?)
A.洗涤烧杯时,要洗到看不见脏东西为准
B.向试管中倾倒液体试剂时,试剂瓶口不能挨着试管口
C.量取液体时视线应与量筒内液体凹液面的最低处相切
D.为加快过滤速度,可用玻璃棒不断搅拌过滤器内的液体
参考答案:C
本题解析:A项,玻璃仪器洗涤干净的标准是:器壁附有水膜,不成滴,也不成股流下,故A不正确。B项,向试管中倾倒液体试剂时,试剂瓶口应挨着试管口,故B不正确。D项,用玻璃棒搅拌过滤器内的液体,可能破坏滤纸,故D不正确。
本题难度:简单