时间:2017-08-01 01:42:04
1、实验题 在实验室我们将乙醇、浓硫酸、冰醋酸混合,利用右图所示的装置制取乙酸乙酯。回答下列问题:? 
⑴浓硫酸的作用是:①______________?②_______________。
⑵饱和碳酸钠溶液的主要作用是_________________。
⑶装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,其目的是____________________。
⑷若要把制得的乙酸乙酯分离出来,应采用的实验操作是_______________。
⑸做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是___________。
2、选择题 实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
[? ]
A. 干燥Cl2
干燥Cl2
B. 吸收HCl
吸收HCl
C. 制取Fe(OH)2沉淀
制取Fe(OH)2沉淀
D. 稀释浓H2SO4
稀释浓H2SO4
3、实验题 用下面所示的A、B、C三种装置都可制取溴苯,请仔细分析三套装置的特点,然后回答下列问题
(1)装置A、C中长导管的作用是___________________。
(2)C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反应开始,对C应进行的操 作是:_________________。
(3)A中存在加装药品和不能及时密封的矛盾,因而在实验中易造成的不良后果是:_______________。
(4)B中采用了双球吸收管,其作用是_______________________;反应后双球吸收管中可能出现的现象是
__________________;双球吸收管内液体不能太多,原因是_____________________。
(5)B装置存在两个明显的缺点,使实验的效果不好或不能正常进行,这两个缺点是:____________________________。
(6)分析上面三套实验装置后,某研究性学习小组又设计了如下图制备溴苯的第四套装置D,请分析其优点: 
①有分液漏斗,可以通过控制液溴的量控制反应的量;
②____________________________;
③烧瓶上方的导气管较长,可以使反应液冷凝回流;
④____________________________。
4、实验题 某同学设计实验室利用铝土矿(主要成分Al2O3,还含有Fe2O3、SiO2等)制取氯化铝的方案,过程如下
(1)用化学式表示过滤1得到的沉淀是______________。
(2)写出步骤②中发生反应的离子方程式:___________。
(3)蒸发AlCl3溶液提取AlCl3需要在HCl气氛中进行,理由是_________________________。
(4)实验证明,熔融的AlCl3不导电,推测其原因是:_________________________最新报道工业采用电解
AlCl3-NaCl熔盐制铝工艺,试写出该电解反应的化学方程式________________________ 。研究证实该熔盐体系中,铝元素以AlCl4-和Al2Cl7-离子的形式存在,则在此工艺中NaCl的作用是__________________
(5)铝是一种重要的金属,下列关于铝的叙述中不正确的是___________(填序号)。
A.铝元素在地壳中含量虽比铁高,但金属铝的使用较晚
B.铝热反应可用于冶炼金属,尤其可以冶炼一些难熔金属
C.铝燃烧时会放出大量的热,可以作为一种生活能源
D.镁和铝与氢氧化钠溶液能形成原电池,在镁电极表面有气体产生
E.用铝板和铂网做电极,以海水为电解质溶液可以制成海洋电池
5、选择题 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图。下列对该实验的描述错误的是 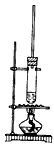
[? ]
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1-丁醇的转化率