时间:2017-08-01 01:33:22
1、简答题 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
(1)常温常压下,在?pH=5的稀醋酸溶液中,c(CH3COO-)=______;下列方法中,可以使0.10mol?L-1?CH3COOH的电离程度增大的是______?
a.加入少量0.10mol?L-1的稀盐酸?b.加热CH3COOH溶液
c.加水稀释至0.010mol?L-1?d.加入少量冰醋酸
e.加入少量氯化钠固体?f.加入少量0.10mol?L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V盐酸______V醋酸,反应的最初速率为:υ盐酸______υ醋酸.
(3)常温下,向体积为Va?mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb?mL至溶液恰好呈中性,则Va与Vb的关系是:______;溶液中各离子的浓度按照由大到小排序为______.已知:90℃时,水的离子积常数为Kw=38×10-14,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=______(保留三位有效数字).
参考答案:(1)在?pH=5的稀醋酸溶液中,c(H+)=10-5mol/L,根据醋酸的电离平衡方程式CH3COOH?H++CH3COO-可以看出,c(CH3COO-)=c(H+)=10-5mol/L,加热、加水稀释、加入碱性物质均能使电离平衡向右移动,故答案为:10-5mol/L;bcf;
(2)醋酸是弱酸,随着它和金属的反应,电离平衡不断地向右移动,会电离出更多的氢离子,所以醋酸产生的氢气体积较大,开始时,醋酸和盐酸的pH均等于3,即开始时氢离子的浓度相等,所以开始时的速率相等,故答案为:<;=;
(3)醋酸溶液是弱酸,pH为3的醋酸溶液中,醋酸的浓度大于10-3mol/L,pH=11的NaOH溶液浓度等于10-3mol/L,最后溶液恰好呈中性,说明碱多,所以Vb>Va,溶液恰好呈中性,氢离子和氢氧根的浓度一定相等,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(Na+)=c(CH3COO-),pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氢氧化钠溶液中c(OH-)=38×10-1410-11=38×10-3mol/L,混合后:H++OH-=H2O,所以碱剩余,剩余的氢氧根的浓度为c(OH-)=38×10-3-?10-32=0.0185mol/L,所以c(H+)=38×10-140.0185≈2.05×10-11(mol/L),故答案为:Vb>Va;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);2.05×10-11mol/L.
本题解析:
本题难度:一般
2、选择题 下列溶液中各离子的浓度关系不正确的是( )
A.0.1 mol·L-1CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
B.浓度均为0.1 mol·L-1 Na2CO3溶液和稀盐酸等体积混合后的溶液中:
c(CO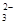 )+c(OH-)=c(H+)+c(H2CO3)
)+c(OH-)=c(H+)+c(H2CO3)
C.25 ℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中:
c(Na+>c(CN-)>c(HCN)>c(OH-)
D. 3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:
c(Na+)>c(CO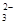 )>c(HCO
)>c(HCO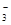 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
参考答案:CD
本题解析:A、物料守恒,正确;B、混合得到NaHCO3,质子守恒,正确;C、此混合溶液中存在HCN电离平衡和NaCN水解平衡,溶液为碱性,以水解平衡为主,故c(HCN)>c(Na+>c(CN-)> c(OH-),错误;
D、0.3mol NaOH通入0.2mol CO2,产物为同浓度的Na2CO3和NaHCO3,其中存在水解和电离平衡,其中以Na2CO3第一步水解为主,故有c(Na+)> c(HCO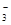 )>c(CO
)>c(CO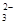 )> c(OH-)>c(H+),错误。
)> c(OH-)>c(H+),错误。
本题难度:一般
3、选择题 已知0.1 mol/L的醋酸溶液中存在电离平衡:? CH3COOH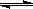 CH3COO-+H+?要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是(? )。
CH3COO-+H+?要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是(? )。
A.加少量CH3COONH4固体
B.降低温度
C.加少量NaOH固体
D.加水稀释
参考答案:D
本题解析:略
本题难度:简单
4、选择题 将pH=11 NaOH溶液和pH=3的甲酸溶液以等体积混合后,对所得溶液,下列判断一定正确的是(?)
A.c(HCOO-)< c(Na+)
B.c(HCOO-)> c(Na+)
C.c(OH-)< c(HCOO-)
D.c(OH-)> c(HCOO-)
参考答案:BC
本题解析:略
本题难度:一般
5、选择题 在25℃时,用蒸馏水稀释1 mol/L的醋酸溶液至0.01 mol/L,随溶液的稀释,下列说法正确的是
A.溶液中所有离子浓度均减小
B.pH的变化值等于2
C.溶液中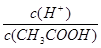 保持增大趋势
保持增大趋势
D.分别与足量的Mg粉反应,0.01 mol/L的醋酸溶液产生的氢气较少
参考答案:C
本题解析:A.醋酸溶液中存在电离平衡,稀释促进电离,氢离子浓度降低。水的离子积常数不变,氢氧根离子浓度增大,A错误;B.由于在稀释过程中氢离子的物质的量增加,则稀释100倍后,pH的变化值小于2,B错误;C.稀释过程中氢离子的物质的量增加,醋酸的物质的量减小,则溶液中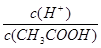 保持增大趋势,C正确;D.稀释过程中醋酸的物质的量不变,则分别与足量的Mg粉反应产生的氢气一样多,D错误,答案选C。
保持增大趋势,C正确;D.稀释过程中醋酸的物质的量不变,则分别与足量的Mg粉反应产生的氢气一样多,D错误,答案选C。
考点:考查醋酸电离平衡的有关判断
本题难度:一般