时间:2017-08-01 01:26:29
1、选择题 已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-13mol?L-1
B.加入Na2CO3固体,可能生成沉淀
C.所加的烧碱溶液pH=13.0
D.所得溶液中的c(Mg2+)=5.6×10-10mol?L-1
参考答案:A.pH=13的溶液中,c (H+)=10-13mol/L,故A正确;
B.加入Na2CO3固体,当c(Mg2+)×c(CO32-)>ksp(MgCO3)时,生成沉淀,故B正确;
C.因为向MgCl2溶液中加NaOH溶液后混合溶液的pH=13,所以所加NaOH溶液pH>13,故C错误;
D.溶液中的c (Mg2+)=5.6×10-12÷10-2=5.6×10-10 mol/L,故D正确.
故选C.
本题解析:
本题难度:简单
2、选择题 根据下列实验内容得出的结论正确的是
| ? | 实验操作 | 解释或结论 |
| A | 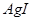 沉淀中滴入浓KCI溶液有白色沉淀出现 沉淀中滴入浓KCI溶液有白色沉淀出现 | 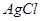 比 比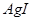 更难溶 更难溶 |
| B | 某物质的水溶液能使红色石蕊试纸变蓝 | 该物质一定是氨气 |
| C | 滴加氯水和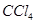 振荡,静置,下层溶液为紫色 振荡,静置,下层溶液为紫色 | 原溶液中有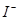 |
| D | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 含有Na单质 |
参考答案:C
本题解析:A、在相同条件下,AgI比AgCl更难溶,、错误;B、某物质的水溶液能使红色石蕊试纸变蓝,溶液呈碱性,不一定为碱溶液,可能为水解呈碱性的盐,错误;C、滴加氯水和CCl4振荡,静置,下层溶液为紫色,原溶液中有I—,正确;D、用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色,该物质中含有钠元素,不一定为钠单质,错误。
本题难度:一般
3、选择题 自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是?
[? ]
A.?CuS的溶解度大于PbS的溶解度
B.?原生铜的硫化物具有还原性,而铜蓝没有还原性
C.?CuSO4与ZnS反应的离子方程式是Cu2++S2-==CuS↓
D.?整个过程涉及的反应类型有氧化还原反应和复分解反应
参考答案:D
本题解析:
本题难度:一般
4、填空题 (13分)Ⅰ、短周期元素X、Y、Z在元素周期表中的相对位置如下图所示。
| | | | X |
| Y | | | Z |
 H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 |
| 平衡常数 | 9.94 | 9 |
 Ni(CO)4(g),ΔH<0。
Ni(CO)4(g),ΔH<0。参考答案:
I、(1)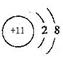 ;
;
(2)CH4
(3)SiO2+2OH-=SiO32-+H2O
(4)SiO2+C Si+CO↑
Si+CO↑
(5)KA+CO2+H2O=HA+KHCO3
II、(6)放热
(7)K=c(H2)c(CO2)/c(CO)c(H2O)
(8)40%;1
(9)C
本题解析:I、25℃,0.1 mol·L-1M溶液(M为Y的最高价氧化物的水化物)的pH为13,说明M是强碱,根据X、Y、Z在元素周期表中的位置判断Y是Na元素,对应的最高价氧化物的水化物是氢氧化钠,为强碱;则X是C元素,Z是Si元素。
(1)Na的离子结构示意图为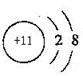 ;
;
(2)C的非金属性大于Si,所以C的气态氢化物CH4的稳定性较强;
(3)因为氢氧化钠与玻璃塞中的二氧化硅反应生成粘性较大的硅酸钠,所以不能用带磨口玻璃塞的试剂瓶盛装氢氧化钠溶液,离子方程式是SiO2+2OH-=SiO32-+H2O;
(4)工业上用单质碳还原二氧化硅制取Si单质,化学方程式是SiO2+C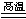 Si+CO↑;
Si+CO↑;
(5)根据所给酸的电离常数可知,酸性H2CO3>HA>HCO3-,所以二氧化碳与KA溶液反应只能生成碳酸氢钾和HA,则化学方程式是KA+CO2+H2O=HA+KHCO3。
II、(6)温度升高,平衡常数减小,说明升高温度,平衡逆向移动,则该反应是放热反应;
(7)根据平衡常数的定义,该反应的平衡常数K=c(H2)c(CO2)/c(CO)c(H2O);
(8)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,则平衡时c(H2)=c(CO2)=2mol/L×60%=1.2mol/L,消耗水蒸气的浓度也是1.2mol/L,则水蒸气的转化率为1.2mol/L/3mol/L×100%=40%;平衡时水蒸气的浓度是3mol/L-1.2mol/L=1.8mol/L,CO的浓度是2mol/L-1.2mol/L=0.8mol/L,代入K=c(H2)c(CO2)/c(CO)c(H2O),则该温度下的平衡常数是1.22/(0.8×1.8)=1;
(9)A、Ni为固体,增加Ni的量,平衡不移动,CO的转化率不变,错误;B、缩小容器容积,压强增大,平衡右移,但ΔH不变,错误;C、反应达到平衡后,充入CO,相当于增大压强,平衡正向移动,则再次达到平衡时,CO的体积分数减小,正确;D、因为该反应有固体参加,气体的总质量分数变化,达到平衡时气体的质量不再变化,则气体的密度不变,所以当容器中混合气体密度不变时,可说明反应已达化学平衡状态,而4v正[Ni(CO)4]= v正(CO)表示正反应速率,不符合正逆反应速率相等的特征,不能判断平衡的到达,错误,答案选C。
考点:考查元素推断,化学用语的书写,化学平衡的移动机平衡常数的应用
本题难度:困难
5、选择题 2007年诺贝尔化学奖获得者德国科学家格哈德·埃特尔在表面化学研究领域作出了开拓性贡献。化学家将研究气体与固体(或液体)在界面上所发生的物理化学现象的科学称为表面化学。对下列现象的研究不属于表面化学范畴的是
A.氯化银在水中的溶解平衡
B.氢氧燃料电池中电极上的反应
C.铁在潮湿的空气中生锈
D.氮气与氢气在铁触媒作用下化合
参考答案:A
本题解析:题干中强调“表面化学”有气体参与,只有A选项的溶解平衡与气体无关,故不属表面化学范畴。
本题难度:一般