时间:2017-08-01 01:24:42
1、选择题 下面关于SiO2晶体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶角
B.最小的环上,有3个Si原子和3个O原子
C.最小的环上,Si和O原子数之比为1:2
D.1molSiO2晶体中含4molSi—O键
参考答案:D
本题解析:略
本题难度:一般
2、填空题 金晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为
1.44×10-10 m,求
(1)金晶体中最小的一个立方体含有__________个金属原子。
(2)金的密度为_________g·cm-3。 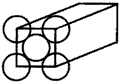
参考答案:(1)4
(2)19.36g·cm-3
本题解析:
本题难度:一般
3、选择题 最近发现一种钛原子和碳原子构成的气态团簇分子,如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为? ( )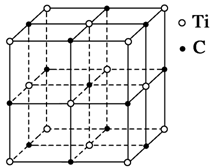
A.Ti14C13
B.TiC
C.Ti4C4
D.Ti4C3
参考答案:A
本题解析:根据题意知,该结构就是其分子结构,分子中含有的原子就是其化学式中含有的原子,直接数出其中的Ti原子和C原子个数即可,其分子式为Ti14C13,故选A。
本题难度:一般
4、填空题 (共计12分)
A.锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)葡萄糖酸锌[CH2OH(CHOH4COO)2Zn是目前市场上流行的补锌剂。写出Zn2+基
态电子排布式?;葡萄糖[CH2OH(CHOH)4CHO]分子中碳原子杂化方式是?。
(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子空间构型为?;
在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在下图中
表示[Zn(NH3)4]2+中Zn2+与N之间的化学键?。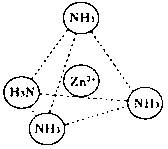
(3)下图表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为?;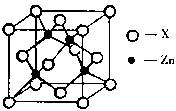
该化合物的晶体熔点比干冰高得多,原因是?。
参考答案:A(12分)
(1)1s22s22p63s23p63d10?(2分)
sp2、sp3(2分)
(2)三角锥形(2分)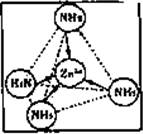 阶段(3分)
阶段(3分)
(3)ZnX 该化合物是原子晶体,而干冰是分子晶体。(3分)
本题解析:略
本题难度:简单
5、选择题 HgCl2稀溶液是外科手术刀的一种消毒剂。HgCl2有如下性质:①晶体熔点较低;②在熔融状态下不能导电;③在水溶液中可发生微弱电离,下列关于HgCl2的叙述中正确的是?(?)
A.HgCl2属于共价化合物
B.HgCl2属于离子化合物
C.HgCl2属于非电解质
D.HgCl2属于弱电解质
参考答案:
AD
本题解析:
因为HgCl2晶体熔点较低、熔融状态不导电,可知其为分子晶体,共价化合物。又因为HgCl2在水溶液中可发生微弱电离,可知HgCl2属于弱电解质。
本题难度:简单