时间:2017-08-01 01:17:24
1、选择题 已知SO3、BF3、CCl4、PCl5、SF6都是非极性分子,而H2S、NH3、NO2、SF4、BrF5都是极性分子,由此可推出ABn型分子属于非极性分子的经验规律是( )
A.ABn型分子中A、B均不含氢原子
B.A元素的相对原子质量必小于B元素的相对原子质量
C.分子中所有原子都在同一平面上
D.ABn型的价层电子对数等于n
参考答案:根据“SO3、BF3、CCl4、PCl5、SF6都是非极性分子,而H2S、NH3、NO2、SF4、BrF5都是极性分子”知,中心原子上的价电子都形成共价键的分子为非极性分子,存在孤电子对的分子为极性分子.
A、ABn型分子中A、B不一定均不含氢原子,如CH4含氢原子但甲烷分子为非极性分子,故A错误;
B、A元素的相对原子质量不一定小于B元素的相对原子质量,如CH4,故B错误;
C、分子中的所有原子不一定都在同一平面上,如CCl4是正四面体结构,故C错误;
D、ABn型的价层电子对数等于n,如PCl5中P原子上的价层电子对是5,BrF5中Br原子上的价层电子对是6,故D正确;
故选D.
本题解析:
本题难度:简单
2、填空题 写出下列物质的电子式:
(1)Ca(OH)2______,H2O______
(2)NH3______,MgO______,
(3)Na2O2______,CCl4______.
参考答案:(1)Ca(OH)2是离子化合物,由由Ca2+离子和OH-离子构成,Ca(OH)2的电子式为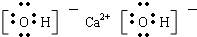
,
H2O是共价化合物,氧原子分别与两个氢原子通过一对共用电子对结合,H2O电子式为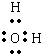
,
故答案为: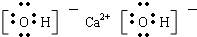
;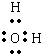
;
(2)NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为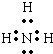
,
MgO是离子化合物,由Mg2+离子和O2-离子构成,MgO的电子式为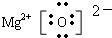
;
故答案为: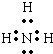
;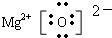
;
(3)Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为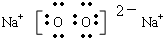
,
CCl4是共价化合物,碳原子分别与4个氯原子通过一对共用电子对结合,CCl4电子式为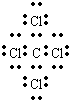
,
故答案为: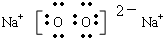
;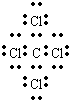
.
本题解析:
本题难度:一般
3、选择题 下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是( )
元素
X
Y
Z
W
原子半径(nm)
0.102
0.16
0.074
0.071
最高正价或最低价
+6
+2
-2
-1
A.原子序数X<Y<W<Z
B.纯净的X与纯净的Z反应生成XZ3
C.Z的最高正价为+6
D.HW是热稳定性最强的氢化物
参考答案:根据化合价可知,X为ⅥA族元素,Y为ⅡA族元素,Z为ⅥA族元素,W为ⅦA族元素,X的原子半径比Z大,则X为S元素,Z为O元素,X与Y的原子半径相近,应位于同周期,则Y为Mg元素,Z与W原子半径相近,则W为F元素.
A、X为S元素,Z为O元素,Y为Mg元素,W为F元素,原子序数关系为O<F<Mg<S,故A错误;
B、X为S元素,Z为O元素,硫在氧气中燃烧只能得到SO2,故B错误;
C、O元素的非金属仅次于氟,没有正价,最高价为0价,故C错误;
D、氟是非金属性最强的元素,HF是稳定性最强的氢化物,故D正确.
故选D.
本题解析:
本题难度:一般
4、选择题 很多化学物质名称中含有“水”,“水”通常有三种含义:①表示水这种物质;②表示水溶液;③表示物质处于液态.下列物质名称中的“水”不属于以上三种含义的是( )
A.水晶
B.水银
C.溴水
D.重水
参考答案:A
本题解析:
本题难度:一般
5、选择题 下列各组物质中,化学键类型完全相同的是
[? ]
A.Cl2和CCl4?
B.HI和NaI
C.H2S和CO2?
D.F2和NaBr
参考答案:C
本题解析:
本题难度:简单