时间:2017-08-01 01:14:30
1、选择题 25℃时,KNO3在水中的饱和溶液物质的量浓度是6mol·L-1,若将1mol固体KNO3置于1L水中,则KNO3变成盐溶液过程的△H-T△S的取值为
A.<0
B.=0
C.>0
D.不能确定
参考答案:A
本题解析:因为1mol固体KNO3置于1L水中,没有达到饱和溶液,是自发进行的过程,所以△G=△H-T△S<0时才是自发过程。
考点:考察利用公式计算判断自发反应过程。
点评:正确理解焓判据和熵判据。
本题难度:一般
2、选择题 下列过程中,共价键被破坏的是(?)
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水⑤冰融化 ⑥NH4Cl“升华”⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水
A.①④⑥⑦
B.④⑥⑧
C.①②④⑤
D.④⑥
参考答案:D
本题解析:①碘升华破坏的是分子间作用力,错误。 ②溴蒸气被木炭吸附破坏的是分子间作用力,错误。 ③酒精溶于水破坏的是分子间作用力,错误。 ④HCl气体溶于水,在水分子的作用下断裂共价键H—Cl键,电离产生自由移动的H+和Cl-.正确。⑤冰融化破坏的是分子间作用力,错误。⑥NH4Cl“升华”就是在加热时发生反应NH4Cl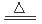 NH3↑+HCl↑,化学键断裂。正确。⑦氢氧化钠是离子化合物,熔化时断裂离子键。错误。 ⑧(NH4)2SO4溶于水在水分子的作用下断裂离子键。错误。
NH3↑+HCl↑,化学键断裂。正确。⑦氢氧化钠是离子化合物,熔化时断裂离子键。错误。 ⑧(NH4)2SO4溶于水在水分子的作用下断裂离子键。错误。
本题难度:一般
3、选择题 氢氧化钠与盐酸的反应属于
A.吸热反应
B.放热反应
C.既是吸热反应也是放热反应
D.都不是
参考答案:B
本题解析:氢氧化钠和盐酸发生中和反应,所有的中和反应都是放热反应,故答案选B.
考点:中和反应
本题难度:一般
4、选择题 下列说法正确的是( )
A.SiCl4、PCl5分子中各原子最外层均达到8电子稳定结构
B.化学反应中能量变化的大小与反应物的质量多少无关
C.经实验测得邻-二溴苯仅一种结构,说明苯环结构中,不存在单双键交替结构
D.需要加热才能发生的反应一定是吸热反应
参考答案:A.SiCl4中,Si最外层电子数为4,成键电子数为4,Cl的最外层电子数为7,成键电子数为1,都达到8电子稳定结构,PCl5分子中P原子最外层电子数为5,成键电子数为5,达到10电子结构,Cl的最外层电子数为7,成键电子数为1,达到8电子稳定结构,故A错误;
B.化学反应中能量变化的大小与反应物的物质的量、质量有关,质量越大,反应的能量变化越大,故B正确;
C.苯环中6个碳碳键完全相同,不存在单双建交替,邻-二溴苯仅一种结构,如实单双键交替,应有2种结构,故C正确;
D.反应的吸、放热与是否加热才能反应无关,如铝热反应为放热反应,但需要加热才能进行,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 下列各组热化学方程式中,△H1<△H2的是
①C(s)+O2(g)===CO2(g) △H1 C(s)+O2(g)="==CO(g) " △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A.①
B.②③④
C.④
D.①②③
参考答案:A
本题解析:略
本题难度:一般