时间:2017-08-01 01:13:46
1、选择题 现在电视上有一“自热米饭”的广告播的很火,它介绍在食用时,将一无色液体加入到一白色固体中,放上装米饭的盒子,过几分钟米饭马上就热气腾腾,就可以食用了,非常方便。请你推测其白色固体和无色液体可能是如下哪个组合 ( )
A.硝酸铵和水
B.浓硫酸和水
C.氧化钙和水
D.固体酒精和水
参考答案:C
本题解析:略
本题难度:一般
2、填空题 化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化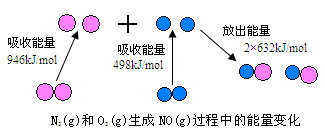
(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为___________ kJ/mol,由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式_______________________
(2)根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H。
C(石墨) + O2(g) = CO2(g);△H1 =" -" 393.5 kJ/mol
2H2(g) + O2(g) = 2H2O(l);△H2 =" -" 571.6 kJ/mol
2C2H2(g) + 5 O2(g) = 4CO2(g) + 2H2O(l);△H3 =" -" 2599.2 kJ/mol,
则由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H _______________________ kJ/mol。
参考答案:(1)946kJ/mol; N2(g) + O2(g)=2NO(g) △H=-220kJ/mol
(2)△H=+226.8kJ/mol
本题解析:(1)根据图中的数据可知,N≡N的键能为946kJ/mol。反应热是断键吸收的能量和形成化学键所放出的能量的差值,则该反应的反应热△H=946kJ/mol+498kJ/mol-2×632kJ/mol=-220kJ/mol,则该反应的热化学方程式是N2(g) + O2(g)=2NO(g) △H=-220kJ/mol。
(2)根据盖斯定律可知,(①×4+②-③)÷2即得到2C(石墨)+ H2(g)=C2H2(g),所以该反应的反应热△H=(-393.5 kJ/mol×4-571.6 kJ/mol+2599.2 kJ/mol)÷2==+226.8kJ/mol。
考点:考查反应热的计算和热化学方程式的书写
点评:该题是高考中的常见题型,属于中等难度试题的考查,试题综合性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和逆向思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是利用好盖斯定律。
本题难度:一般
3、选择题 下列描述中正确的是
A.需要加热才能发生的反应一定是吸热反应
B.中和反应都是放热反应
C.放热反应的反应速率总是大于吸热反应的反应速率
D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的 不同
不同
参考答案:B
本题解析:A、有些放热反应也需要加热,不选A;B、中和反应都是放热反应,选B;C、反应的速率取决于反应物的性质,不选C;D、反应热和反应的条件没有关系,不选D。
考点:反应的热效应。
本题难度:一般
4、选择题 反应H2(g) +Br2(l) 2HBr(g)在25 ℃、101 kPa下进行, 已知生成2molHBr放出热量为72 kJ,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
2HBr(g)在25 ℃、101 kPa下进行, 已知生成2molHBr放出热量为72 kJ,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
| 1 mol分子中的化学键断时需要吸收能量/kJ | H2(g) | Br2(g) | HBr(g) |
| 436 | a | 369 |
参考答案:D
本题解析:根据键能与反应热的关系可知:436+30+a-369×2=-72,解得a=-200.因此断开1molBr2(g) 分子中的化学键断时需要吸收能量200kJ,故选项是D。[来源:Zx
考点:考查物质的存在状态、反应热与化学键的键能的关系的知识。
本题难度:一般
5、填空题 (14分)现有反应:mA(g)+ B(g) 2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
(1)该反应的△H 0(填“>”或“<”),且m 1(填“>”“=”“<”)。
(2)若加入B(假设容器的体积不变),则A的转化率 ,B的转化率 。(填“增大”“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(假设容器的体积不变)时混合物颜色 ,
若维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”)。
(4)一定温度下,向1L密闭容器中加入1mol C(g)使其分解,气体A的物质的量随时间的变化如下图所示。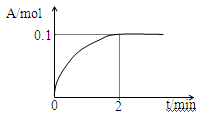
则0~2 min内的平均反应速率υ(C)= 。
参考答案:(1) <;= (2)增大 减小 (3)变深 变浅 (4) 0.1mol·L-1·min-1
本题解析:(1)达到平衡后,当升高温度时,A的转化率变小;说明温度升高平衡向逆反应方向移动,则正反应放热,逆反应为吸热反应,当减小压强时,混合体系中C的质量分数不 变,说明压强减小平衡不移动,则方程式中反应物的气体的计量数之和等于生成物气体的化学计量数之和,故答案为:<、=;
(2)若加入B(假设容器的体积不变)平衡向正反应方向移动A的转化率增大,B的转化率减小。故答案为:增大、减小
(3)加入C时平衡左移颜色加深,维持压强不变,充入氦气容器体积膨胀,气体浓度减小颜色变浅。故答案为:加深、变浅
(4)由图可知反应中A增加了0.1 mol,根据方程式A(g)+ B(g) 2C(g)得C分解了0.2 mol,故则0~2 min内的平均反应速率υ(C)= 0.1mol·L-1·min-1
2C(g)得C分解了0.2 mol,故则0~2 min内的平均反应速率υ(C)= 0.1mol·L-1·min-1
考点:化学反应平衡的移动、化学反应速率的计算。
本题难度:一般