时间:2017-08-01 00:40:02
1、填空题
pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6。
(1)写出生成的正盐的分子式:__________。
(2)该盐中存在着一定水解的离子,该离子的水解方程式为____________。
(3)简述该混合液呈酸性的原因:__________________。
2、选择题 亚硫酸(H2SO3)是二元弱酸,KHSO3溶液呈酸性.向10mL?0.01mol/L的H2SO3溶液滴加0.01mol/LKOH溶液VmL,下列判断错误的是( ? )
A.当V=10mL时,c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3)
B.当V=20mL时,c(K+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
C.当V>0时,c(K+)+c(H+)=2c(SO32-)+c(OH-)+c(HSO3-)
D.当V=20mL时,再滴入NaOH溶液,则溶液中n(K+)/n(SO32-)的值将变大
3、选择题 下列化学原理表述正确的是
[? ]
A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大
B.Na2CO3溶液中满足:c(?Na+)==2c(CO32-)+2c(HCO3-?)+2c(H2CO3)
C.NaHCO3溶液不显中性的原因:HCO3-?+H2O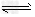 CO32-?+H3O+
CO32-?+H3O+
D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速度快,生成H2的物质的量多
4、选择题 把溶液AlCl3与NaHCO3溶液分别蒸干灼烧,最后得到的固体产物分别为( )
A.AlCl3、NaHCO3
B.Al(OH)3、NaHCO3
C.Al2O3、NaOH
D.Al2O3、Na2CO3
5、选择题 盐类水解程度的大小可用“水解度”来表示,NaA型盐的水解度为已水解的离子的物质的量占该离子原来总物质的量的百分数.用0.040mol?L-1NaOH溶液10.0mL与0.020mol?L-1的某一元弱酸HA20.0mL恰好完全中和,所得溶液pH值为10.则所得NaA溶液的水解度为( )
A.0.25%
B.0.50%
C.0.75%
D.1.0%