时间:2017-08-01 00:30:33
1、选择题 人体正常血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化为Fe3+而中毒,服用维生素C可以解毒。对上述事实分析正确的是(?)
A.亚硝酸盐是还原剂
B.维生素C是氧化剂
C.亚硝酸盐将Fe3+还原成Fe2+
D.维生素C被Fe3+氧化
参考答案:D
本题解析:略
本题难度:一般
2、选择题 等质量的铜片在酒精灯上热后,分别插入下列液体中,放置片刻后取出,铜片质量不变的是(?)
A.盐酸
B.无水乙醇
C.冰醋酸
D.乙醛
参考答案:B
本题解析:略
本题难度:简单
3、实验题 某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。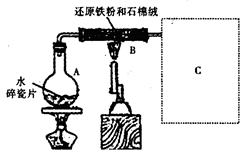
(1)装置B中发生反应的化学方程式是?。
(2)虚线框图C的气体收集装置是下图中的??(选填字母编号)。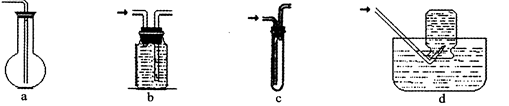
(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g。再向固体中加入过量稀盐酸充分反应,并进行如下实验:?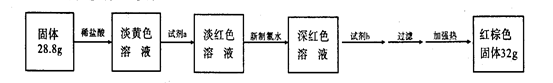
试剂a的化学式是?,试剂b的化学式是?;加入新制氯水后溶液红色加深的原因是(用离子方程式表示)?。
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究。首先提出假设。假设1:溶液中的+3价铁被氧化为更高的价态;假设2:
?;为了对所提出的假设2进行验证,实验方案是?
??。
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为?。
参考答案:
(1)3Fe + 4H2O 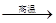 ?Fe3O4 + 4H2↑ (1分)
?Fe3O4 + 4H2↑ (1分)
(2)bd?(2分)
(3)KSCN ,NaOH;2Fe2++Cl2→2Fe3++2Cl-?(1分1格,共3分)
(4)SCN-被过量的氯水氧化;(2分)
取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2 正确,若不变红,则假设2不正确。(2分)
(5)77.8% (2分)
本题解析:(2)氢气难溶于水,可用排水法收集。选bd。
(3)因为铁和水反应生成Fe3O4,Fe3O4,+8HCl=2FeCl3+FeCl2+4 H2O 。淡黄色溶液含少量Fe3+,加a:KSCN,Fe3++3SCN- =Fe(SCN)3 ?少量淡红色。加新制的氯水,把FeCl2氧化变成FeCl3和KSCN生成
Fe(SCN)3,再加NaOH,能生成Fe(OH)3 ?。加热Fe(OH)3变成红棕色的Fe2O3
(4)“SCN-被过量的氯水氧化”,为证明此假设,需加过量的KSCN溶液,看是否变红。
(5)解设原铁元素的质量为x
2Fe------- Fe2O3
2*56? 160
x? 32? x=22.4
Fe%=22.4*100%/28.8=77.8%
本题难度:困难
4、实验题 下图是铁粉和水蒸气反应的实验装置示意图。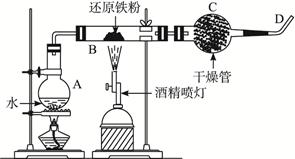
(1)写出该反应的化学方程式______________________________________________。
(2)实验中,D处排出的气体几乎点不着,已知该装置不漏气,使用的各种药品没有质量问题,你认为气体点不着的可能原因是:_______________________________________。
改正的措施是:___________________________________________________________。
(3)有人建议将烧瓶中的水改用纯碱晶体(NaCO3·10H2O),你认为是否可行?____________________,理由是_________________________________________________。
参考答案:(1)3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(2)可能的原因:①产生的H2太少,②水蒸气过多
改正措施:①增加还原铁粉的用量,②控制烧瓶加热温度,避免产生大量水蒸气。(或增加干燥剂的用量)
(3)可行。Na2CO3·10H2O受热产生平稳的水蒸气流,也能避免产生大量水蒸气。
本题解析:观察整个装置图,弄清每个装置的作用。结合题干信息可知烧瓶A是提供水蒸气的,Fe粉与水蒸气在B处发生反应,生成Fe3O4和H2,H2经干燥管C11后逸出。D处H2无法点燃,可能是因为H2量太少或H2中的含水蒸气。改正的措施也从以上两个途径考虑。
本题难度:一般
5、选择题 下列关于铁元素的叙述中正确的是( )
A.2Fe3++Cu===2Fe2++Cu2+成立说明氧化性:Fe3+> Cu 2+
B.25℃,pH=0的溶液中,Al3+、NH4+、NO3—、Fe2+可以大量共存
C.5.6 g铁与足量的氯气反应失去电子为0.2 mol
D.硫酸铁溶液中加入铁粉,滴加KSCN溶液一定不变红色
参考答案:A
本题解析:A、反应中Fe3+做氧化剂 Cu 2+是氧化产物。根据氧化还原反应的氧化性判断规律,氧化性:氧化剂>氧化产物,所以A正确。故选A。
B、pH=0的溶液中,溶液含有较大浓度的H+,NO具有强氧化性与还原性的Fe2+不能大量共存。
C、5.6gFe为0.1mol与氯气反应时被氧化成Fe3+失去电子为0.3mol。故C错误。
D、硫酸铁溶液中加入铁粉,Fe3+不一定反应完全,滴加KSCN溶液有可能变红色。D错误。
点评:掌握铁及其化合物的相关性质是解题的关键。
本题难度:一般