时间:2017-08-01 00:24:22
1、选择题 下列溶液中不能存放在带玻璃塞的试剂瓶中的是
①?氢氟酸 ②? NaCl ③? KNO3 ④? Na2SiO3 ⑤? CuSO4 ⑥? NaOH ⑦? Na2CO3 ⑧? NaHSO4
A.①④⑥⑦
B.①③⑤⑧
C.②③④⑦
D.①④⑥⑧
参考答案:A
本题解析:略
本题难度:一般
2、填空题 作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一。重庆一中某化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究。
I. 甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,跟随父母来到重庆后,总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知以下信息:
①醋分两种,酿造醋和配制醋。正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋。
②酿造醋国家标准为醋酸含量必须大于3.50 g/100mL,而配制醋国家标准仅为1.50 g~3.50g/100mL。
③在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.75mol/L。
(1)请帮助张同学计算从超市购买的食醋中醋酸含量为_______g/100mL,属于____________醋(填“酿造”或“配制”)。(提示:醋酸摩尔质量为60g/mol)
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式_______________________________。
II. 下图是重庆一中化学实验室浓盐酸试剂标签上的部分内容。乙同学现用该浓盐酸配100mL1mol/L的稀盐酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒。请回答下列问题: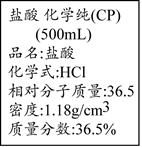
(1)配制稀盐酸时,还缺少的仪器有?;
(2)经计算,配制100mL1mol/L的稀盐酸需要用量筒量取上述浓盐酸的体积为?mL(保留小数点后一位);
(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol/L,引起误差的原因可能是?。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定 容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
III. 丙同学对课堂上学到的胶体的相关知识产生了浓厚兴趣。
(1)他利用买来的鸡蛋的蛋清配制成溶液,用激光笔照射溶液,发现一条光束穿过鸡蛋清溶液,此现象称为____________________。
(2)他将乙同学配制好的盐酸溶液加入到鸡蛋清溶液中,发现出现絮状沉淀,此现象称为_________。
IV. 丁同学试图测定CO2的相对分子质量。
①利用丙同学用完后剩下的鸡蛋壳和乙同学配制好的稀盐酸溶液制备CO2;
②查询相关书籍后,设计了如下装置: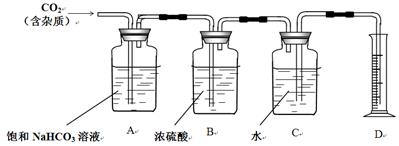
(1)B装置在此处____必要(填写“有”、“无”)请简述原因_________________________________。
(2)A装置中的饱和NaHCO3溶液可以吸收______________。
(3)实验前测得C装置(含水)重量为50.00g,实验完毕后C装置(含水)重量为40.02g,D中量筒读数为10.0 mL,已知H2密度为0.09g/L(以上数据均已折合为标况下数值),请根据以上数据,计算CO2的相对分子质量为____________(保留小数点后一位)。
参考答案:I.(1)? 4.50(有效数字酌情扣分)?酿造
(2)CaCO3+2CH3COOH=Ca2++2CH3COO- +CO2↑+H2O
II. (1)100 mL容量瓶?(2)8.5 mL?(3)CD
III. (1)丁达尔效应(2)胶体的聚沉
IV. (1)无?排水法收集气体,不需要对气体进行干燥 (2)HCl?(3)44.4
本题解析:I.(1)醋酸的物质的量浓度为0.75mol/L,则食醋中醋酸含量为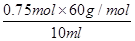 =4.50g/100mL>3.50 g/100mL,所以属于酿造醋。
=4.50g/100mL>3.50 g/100mL,所以属于酿造醋。
(2)醋酸的酸性强于碳酸,能和碳酸钙反应生成醋酸钙、CO2和水,反应的离子方程式为CaCO3+2CH3COOH=Ca2++2CH3COO- +CO2↑+H2O。
II.(1)要配制100mL1mol/L的稀盐酸,需要量筒、烧杯、玻璃棒、100 mL容量瓶和胶头滴管,因此还缺少的是100ml容量瓶。
(2)根据c=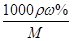 可知,该浓盐酸的浓度c=
可知,该浓盐酸的浓度c=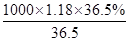 mol/L=11.8mol/L。根据稀释过程中溶质不变可知,配制100mL1mol/L的稀盐酸需要用量筒量取上述浓盐酸的体积为
mol/L=11.8mol/L。根据稀释过程中溶质不变可知,配制100mL1mol/L的稀盐酸需要用量筒量取上述浓盐酸的体积为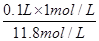 =0.0085L=8.5ml。
=0.0085L=8.5ml。
(3)根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。A、定容时俯视容量瓶刻度线,则容量瓶中溶液体积减小,则所配溶液浓度偏高;B、容量瓶在使用前未干燥,里面有少量蒸馏水对结果无影响,B不正确;C、转移溶液后,未洗涤烧杯和玻璃棒,则溶质减少,所配浓度偏小;D、定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线,则溶液体积增加,所配浓度偏小,答案选CD。
III.(1)胶体能产生丁达尔效应,鸡蛋的蛋清配制成溶液属于胶体,因此用激光笔照射溶液,可以发现一条光束穿过鸡蛋清溶液,此现象称为丁达尔效应。
(2)胶体和电解质混合可以聚沉。盐酸是电解质氯化氢的水溶液,所以将配制好的盐酸溶液加入到鸡蛋清溶液中,会出现絮状沉淀,此现象称为胶体的聚沉。
IV. (1)根据装置可知, CO2用排水法收集,因此在收集之前不需要对气体进行干燥,即没有必要设计B装置。
(2)由于盐酸易挥发,因此生成的CO2气体中含有挥发出的氯化氢气体,所以A装置中的饱和NaHCO3溶液的作用是吸收氯化氢。
(3)实验前测得C装置(含水)重量为50.00g,实验完毕后C装置(含水)重量为40.02g,D中量筒读数为10.0 mL,这说明收集到CO2的质量=40.02g+10.0g-50.0g=0.02g,其体积是10.0ml,所以CO2的密度=0.02g÷0.01L=2g/L。已知H2密度为0.09g/L(以上数据均已折合为标况下数值),则根据在相同条件下气体的密度之比等于相对分子质量之比可知,CO2的相对分子质量=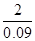 ×2=44.4。2制备、收集以及CO2相对分子质量测定的实验探究
×2=44.4。2制备、收集以及CO2相对分子质量测定的实验探究
本题难度:一般
3、选择题 实验室用已知浓度的盐酸标准溶液滴定未知浓度的NaOH溶液,下列操作导致中和滴定实验结果偏高的原因是(?)
A.盛标准液的滴定管尖嘴部位有气泡,在滴定时气泡消失
B.酸式滴定管读数时,滴定前仰视,滴定终了时又俯视
C.量取待测液的滴定管,用水洗后,未用待测液润洗
D.滴定时用的锥形瓶中加入待测液后又加少量水稀释
参考答案:A
本题解析:A:气泡的体积显示为标准溶液的体积,使其偏大,最终测定结果偏高
B:两次错误操作均导致标准溶液的体积偏小,测定结果偏低
C:滴定管未润洗,导致待测溶液浓度偏小,标准溶液体积偏小,测定结果偏低
D:不影响测定结果
答案为A
本题难度:一般
4、选择题 用下列实验装置完成对应实验(部分仪器已省略),不能达到实验目的是( )
A.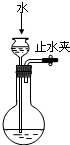
检查装置气密性
B.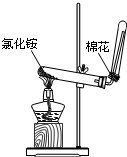
实验室制氨气
C.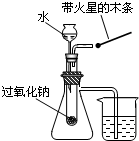
验证过氧化钠与水反应既生成氧气又放热
D.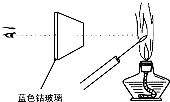
检验K2CO3中的K+
参考答案:A.用弹簧夹夹住右边导管,向长颈漏斗中倒水,液面高度不变,说明装置气密性良好,故A正确;
B.实验室用氯化铵和碱石灰反应制取氨气,即碱与盐反应生成新碱和新盐,化学方程式为:2NH4Cl+Ca(OH)2△.CaCl2+2NH3↑+2H2O,氯化铵分解生成氨气和氯化氢,氨气和氯化氢冷却生成氯化铵,无法制取纯净的氨气,故B错误;
C.2H2O+2Na2O2=O2↑+4NaOH,把一根带火星的木条放在管口处,木条复燃,证明是氧气,盛放过氧化钠的试管是封闭的,封闭了一段空气,当过氧化钠和水反应放热,气体被加热,体积膨胀,通过支管向烧杯中排放,看到烧杯水中有气泡说明该反应放热,故C正确;
D.在进行焰色反应时,由于Na+燃烧呈黄色,干扰了K+的焰色反应(紫色)的观察,所以必须把黄色的光滤去,透过蓝色钴玻璃观察K+的焰色反应(紫色),故D正确;
故选B.
本题解析:
本题难度:一般
5、选择题 下列实验仪器能直接加热的是
A.烧杯
B.量筒
C.容量瓶
D.试管
参考答案:D
本题解析:分析:能够直接加热的仪器有:试管、燃烧匙、蒸发皿和坩埚等;需要垫石棉网的是:烧杯、烧瓶、锥形瓶等.不能加热的仪器有:漏斗、量筒、集气瓶等.
解答:A.烧杯不能直接加热,需要垫石棉网,故A错误;
B.量筒用于量取液体的体积,不能进行加热,故B错误;
C.容量瓶不能用于加热,故C错误;
D.试管可以直接加热,故D正确.
故选D.
点评:本题考查直接加热的实验仪器,难度不大,了解常见仪器的名称、性质、作用是解题的关键.
本题难度:困难