时间:2017-08-01 00:19:16
1、选择题 某氨水的pH=a,某盐酸的pH=b,已知a+b=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是
A.c(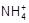 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
B.c(Cl-)>c(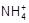 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.c(Cl-)>c(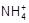 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.c(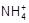 )+c(H+)=c(Cl-)+c(OH-)
)+c(H+)=c(Cl-)+c(OH-)
参考答案:D
本题解析:氨水和盐酸发生中和反应生成氯化铵和水,则根据电荷守恒可知c(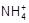 )+c(H+)=c(Cl-)+c(OH-),所以选项D正确,AB不正确;由于氨水是弱碱,且a+b=14,所以在反应中氨水是过量的,溶液显碱性,应该是c(
)+c(H+)=c(Cl-)+c(OH-),所以选项D正确,AB不正确;由于氨水是弱碱,且a+b=14,所以在反应中氨水是过量的,溶液显碱性,应该是c(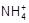 )>c(Cl-)>c(OH-)>c(H+),C不正确,答案选D。
)>c(Cl-)>c(OH-)>c(H+),C不正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确酸碱中和后溶液酸碱性的判断,首先要判断酸碱的过量问题。只有当酸碱恰好反应时,才能考虑生成的盐是否水解,其次要利用好电荷守恒、物料守恒以及质子守恒。
本题难度:一般
2、选择题 下列热化学方程式中的反应热下画线处表示燃烧热的是
[? ]
A.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H= -akJ/mol
B.CH3CH2OH(l)+1/2O2(g)=CH3CHO(l)+H2O(l) △H=-bkJ/mol
C.CO(g)+1/2O2(g)=CO2(g) △H=-ckJ/mol
D.NH3(g)+5/4O2(g)=NO(g)+6/4H2O(g) △H=-dkJ/mol
参考答案:AC
本题解析:
本题难度:简单
3、选择题 已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2?ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是 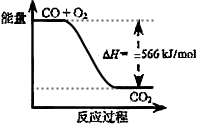
[? ]
A.CO的燃烧热为283 kJ
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
参考答案:C
本题解析:
本题难度:一般
4、选择题 25℃时,某水溶液中由水电离的c(H+)=1.0×10-10mol/L,则该溶液不可能是?
A.FeCl3溶液
B.盐酸
C.氨水
D.NaOH溶液
参考答案:A
本题解析:略
本题难度:一般
5、选择题 室温下,水的电离达到平衡:H2O H++OH-。下列叙述正确的是
H++OH-。下列叙述正确的是
A.将水加热,平衡向正向移动,Kw不变
B.向水中加入少量NaOH固体,平衡向逆向移动,c(OH-)增大
C.新制氯水久置后,水的电离平衡向正向移动,c(OH-)增大
D.向水中加入少量CH3COONa固体,平衡向正向移动,Kw增大
参考答案:B
本题解析:电离是吸热的,所以升高温度,促进水的电离,水的离子积常数也增大,A不正确。氢氧化钠电离出OH-,增大OH-浓度,抑制水的电离,B正确。新制氯水久置后,变成向盐酸,酸性增强,抑制水的电离,C不正确。醋酸钠是强碱弱酸盐,CH3COO-水解促进水的电离,但水的离子积常数不变,D不正确,答案选B。
本题难度:简单