时间:2017-08-01 00:17:05
1、选择题 甲、乙是周期表中相邻2个主族的2种元素,若甲的原子序数为x,则以下有可能是乙的原子序数的是
A.x-17
B.x-8
C.x-6
D.x+18
参考答案:A
本题解析:价奇序奇(即元素化合价是奇数,原子序数也为奇数);价偶序偶(即元素化合价是偶数,原子序数也为偶数)等;奇偶差(和)为奇,奇奇差为偶,偶偶差为偶.利用奇偶差为奇,答案为A.
本题难度:困难
2、选择题 下列物质性质比较正确的是( )
A.热稳定性:HCl>H2S>H2O
B.离子半径:Na+>Cl一>F-
C.碱性:NaOH>Mg(OH)2>Al(OH)3
D.熔点:金刚石>干冰>食盐
参考答案:A、非金属性越强,气态氢化物越稳定,非金属性O>Cl>S,则氢化物稳定性为H2O>HCl>H2S,故A错误;
B、电子层数越多半径越大,电子层数相同时原子序数越大半径越小,所以离子半径:Cl一>F->Na+,故B错误;
C、元素的金属性越强其对应的最高价氧化物对应的水化物的碱性越强,金属性:Na>Mg>Al,则碱性:NaOH>Mg(OH)2>Al(OH)3,故C正确;
D、熔点的一般规律为:原子晶体>离子晶体>分子晶体,所以熔点:金刚石>食盐>干冰,故D错误;
故选C.
本题解析:
本题难度:一般
3、填空题 短周期元素X、Y、Z在周期中位置关系如图所示。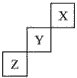
(1)X元素的单质分子式是________,若X核内中子数与质子数相等,X单质的摩尔质量是__________。
(2)Z元素的单质是一种_______色的_________体。该单质与铁粉反应的化学方程式为_______________________________。
(3)Y元素的单质与H2O反应的化学方程式为___________________________,若1molY单质反应,转移
___________mol电子。
参考答案:(1)He;4g/mol
(2)淡黄;固;Fe+S FeS
FeS
(3)2F2+2H2O==4HF+O2;2
本题解析:
本题难度:一般
4、选择题 下列顺序表述正确的是( )
A.酸性:H3PO4>HNO3>HClO4
B.稳定性:H2O>HF>H2S
C.原子半径:Na>Mg>O
D.还原性:F->Cl->S2-
参考答案:A.非金属性:Cl>N>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则HClO4>HNO3>H3PO4,故A错误;
B.非金属性:F>O>S,元素的非金属性越强,对应的氢化物越稳定,则稳定性:HF>H2O>H2S,故B错误;
C.同周期元素从左到右元素的原子半径逐渐减小,则Na>Mg,原子核外电子层数越多,半径越大,则最小的为O,所以原子半径:Na>Mg>O,故C正确;
D.非金属性:F>Cl>S,元素的非金属性越强,对应的阴离子的还原性越弱,则还原性:F-<Cl-<S2-,故D错误.
故选C.
本题解析:
本题难度:一般
5、推断题 短周期中的A、B、C、D、E 5种元素,原子序数依次增大,A、D同主族;A、B的原子序数之和等于C的原子序数;C2-与D+的核外电子数相等;B原子与D+的核外电子数之和等于E原子的核外电子数,且D、E两元素能形成微粒个数比为1:1的离子化合物。
(1)E元素的离子结构示意图为____________。
(2)A与B元素、A与C元素均可构成18电子的分子,其化学式分别为___________、____________。
(3)A、C元素可组成原子个数比为1:1的共价化合物乙,将E 单质通入乙的水溶液中,生成一种强酸,并有气体放出,反应的化学方程式为__________________。
(4)A、B、C、D、E中的任意三种元素可组成多种化合物,X和Y是其中的两种。X和Y都是既含离子键又含共价键的离子化合物;将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的
pH<7,Y水溶液的pH >7。将0. 2mol/L的X溶液与0. 1mol/L的Y溶液等体积混合后,溶液呈碱性。请判断:①X的化学式为________,Y的化学式为_________;②混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为_______________。
参考答案:(1)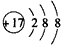 (2)N2H4;H2O2
(2)N2H4;H2O2
(3)H2O2 +Cl2 =2HCl+O2
(4)①NH4Cl(或NH4NO3);NaOH;②c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
本题解析:
本题难度:困难