时间:2017-08-01 00:00:11
1、填空题 某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
【实验1】:如图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细.电解开始
30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色.
【实验2】:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
| 序号 | 操作 | 现象 ① 滴入稀硝酸溶液 沉淀溶解,有无色气泡产生,最终得到蓝色溶液. ② 滴入稀硫酸溶液 橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
| 物质 | 颜色 | 物质 | 颜色 氯化铜 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 氢氧化亚铜(不稳定) 橙黄色 碱式氯化铜 绿色 氢氧化铜 蓝色 氧化亚铜 砖红色或橙黄色 氯化亚铜 白色 |
参考答案:(1)氯化铜中铜的化合价为+2价,氧化亚铜中铜的化合价为+1价,所以铜的常见正化合价为+1、+2;根据常见铜的化合物颜色判断,试管底部橙黄色沉淀的物质是Cu2O.
故答案为:+1、+2; Cu2O.
(2)电解时,铜作阳极,阳极上铜失电子生成亚铜离子进入溶液,亚铜离子和氯离子生成氯化亚铜白色沉淀,所以电极反应式为2Cu+2Cl--2e-=2CuCl↓.
故答案为:2Cu+2Cl--2e-=2CuCl↓.
(3)①根据实验现象及硝酸和氧化亚铜的性质、及常见铜的化合物颜色判断,生成物是一氧化氮、硝酸铜和水,所以离子方程式为3Cu2O+2H++2NO3-=6Cu2++2NO↑+7H2O
②根据实验现象及常见铜的化合物颜色,生成物是铜、硫酸铜和水,所以离子方程式为Cu2O+2H+=Cu+Cu2++H2O.
故答案为:3Cu2O+2H++2NO3-=6Cu2++2NO↑+7H2O;Cu2O+2H+=Cu+Cu2++H2O.
本题解析:
本题难度:一般
2、填空题 按下图中装置实验,A、B两烧杯分别盛放200 g 10% NaOH溶液和足量CuSO4溶液。通 电一段时间后,c极上有Cu析出,又测得A杯溶液中NaOH的质量分数为10.23%,试回答:
(1)电源的P极为________极。
(2)b极产生气体的体积为________L(标准状况)。
(3)c极上析出沉淀的质量为________g。
(4)d极上所发生的电极反应式为:________________。
参考答案:(1)负
(2)2.8
(3)16
(4)4OH--4e-→2H2O+O2↑
本题解析:
本题难度:一般
3、填空题 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.已知:
CH3OH(l)+O2(g)===CO(g)+2H2O(g) ΔH1=-443.64?kJ/mol
2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0?kJ/mol
(1)试写出CH3OH(l)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:______________________________________________.
(2)科研人员新近开发出一种由强碱作电解质溶液的新型甲醇手机电池,可使手机连续使用一个月才充一次电,据此回答:甲醇在________极反应.
(3)利用电池可实现电能向化学能的转化.某同学设计了一种用电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中不正确的是________(填序号).
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解质溶液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是2H++2e-===H2↑ 
参考答案:(1)2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1453.28?kJ/mol
(2)负
(3)C
本题解析:
本题难度:一般
4、选择题 用惰性电极电解下列溶液一段时间后,再加入一定量的某纯净物(括号内),假定产生的气体全部逸出,不能使电解后的溶液与原来溶液的成分、浓度均相同的是
[? ]
A.CuCl2(CuCl2)
B.Na2SO4(H2O)
C.AgNO3(Ag2O)
D.CuSO4(Cu(OH)2)
参考答案:D
本题解析:
本题难度:一般
5、选择题 如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解片刻,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是(?)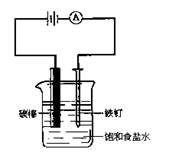
A.Cl2
B.O2
C.H2
D.HCl
参考答案:A
本题解析:略
本题难度:简单