时间:2017-07-31 23:51:44
1、选择题 下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液,下列实验现象中正确的是

[? ]
参考答案:D
本题解析:
本题难度:一般
2、填空题 (8分)氯碱工业中电解饱和食盐水的原理示意图如图所示: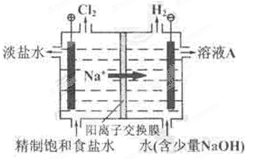
(1)溶液A的溶质是?;
(2)电解饱和食盐水的离子方程式是?;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用?;
检验阳极反应产物的方法是:______________________________________________________
___________________________________________________________________________________
参考答案:(1)NaOH
(2)2Cl-+2H2O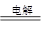 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)氯气与水反应:Cl2+H2O HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出;用湿润的淀粉碘化钾试纸放在集气瓶口,变蓝。
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出;用湿润的淀粉碘化钾试纸放在集气瓶口,变蓝。
本题解析:
⑴阴极室,产生H2后留下OH―,A的溶质是NaOH;
⑵2Cl-+2H2O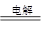 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
⑶氯气与水反应:Cl2+H2O HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出;检验阳极反应产物的方法是:用湿润的淀粉碘化钾试纸放在集气瓶口,变蓝。
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出;检验阳极反应产物的方法是:用湿润的淀粉碘化钾试纸放在集气瓶口,变蓝。
本题难度:简单
3、选择题 下列说法正确的是
[? ]
A.△H<0,△S>0的化学反应一定能自发进行
B.得电子难的物质,失电子一定容易
C.可根据分敞质直径大小,把“烟”和“雾”区别开来
D.铜作阳极电解盐酸时的反应为Cu+2Cl- Cu2++Cl2↑
Cu2++Cl2↑
参考答案:A
本题解析:
本题难度:简单
4、填空题 光伏组件采用高效率单晶硅或多晶硅光伏电池、高透光率钢化玻璃、抗腐蚀铝合多边框等材料,使用先进的真空层压工艺及脉冲焊接工艺制造。
(1)钢化玻璃的成分为____________(写化学式)。
(2)光伏电池的能量转换形式正确的是__________(填字母代号)。
a.化学能转换为电能
b.光能转换为化学能再转换为电能
c.光能转换为热能再转换为电能
d.光能转换为电能
(3)下图是太阳能电池板经太阳光照射前后内部电子的变化情况,图乙中灯泡变亮,其中___(填写“N” 或“P”)是正极。 
(4)下图是一个太阳能路灯,图中的④是蓄电池。镍氢电池就是这样一种与太阳能电池配套使用的蓄电 池,白天用于充电,夜间供电。这种蓄电池容量大,充电放电循环寿命也较长。该蓄电池的总反应为:
Ni(OH)2 NiOOH+1/2H2↑。
NiOOH+1/2H2↑。 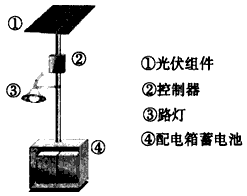
镍氢电池的电解液采用30%的KOH溶液,白天充电反应时的阳极反应式为_______________,夜间放电时,负极附近溶液的pH______(填“增大”、“减小”或“不变”)。
参考答案:(1)Na2SiO3、CaSiO3、SiO2等
(2)d
(3)P
(4)Ni(OH)2+OH--e-=NiOOH+H2O;减小
本题解析:
本题难度:一般
5、选择题 下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
参考答案:C
本题解析:由于电流的方向是从电源的a电极到电解池的c,所以a是正极,b是负极。则c的阳极,d的阴极。在电解过程中由于阳离子的放电能力:Cu2+> H+,所以在阴极d电极上发生反应:Cu2++2e-=Cu, d电极质量增加;由于阴离子的放电能力:Cl->OH-,所以在阳极c上发生反应:2Cl-—2e-=Cl2↑.因此氯离子浓度会减小,在c电极上放出黄绿色的气体。因此正确的选项是C。
本题难度:一般