时间:2017-07-31 23:37:27
1、选择题 下列化合物中,属于共价化合物的是( )
A.MgF2
B.SO2
C.Na2O
D.K2S
参考答案:B
本题解析:
本题难度:一般
2、选择题 三氟化氮(NF3)是无色无味的气体,它可由氨气和氟气反应得到,反应的化学方程式为:
4NH3+3F2 ==NF3+3NH4F。下列有关NF3的叙述不正确的是
[? ]
A.NF3中N呈+3价?
B.NF3是共价化合物
C.NF3的氧化性比F2强
D.NF3分子呈三角锥形
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列选项错误的是
[? ]
A.在NH4Cl晶体中含有离子键和共价键
B.设想把“H2+ Cl2=2HCl”设计成燃料电池,用于工业制盐酸,并进行发电
C.某反应△H >0,△S >0,该反应是个非自发反应
D.25℃时,NaNO2溶液的pH =8,c(Na+) -c(NO2-)= 9.9×10-7mol/L
参考答案:C
本题解析:
本题难度:一般
4、选择题 固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是( )
A.1 mol NH5中含有5 NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键
C.NH5的电子式为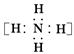 +
+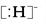
D.它与水反应的离子方程式为NH4++H-+H2O NH3·H2O+H2↑
NH3·H2O+H2↑
参考答案:A
本题解析:NH5中所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则可以预测它是铵盐,其中有氢负离子。1 mol NH5中含有4 NA个N—H键,故A项错误;铵盐中既有离子键又有共价键,B正确;C、 D项都正确。
本题难度:一般
5、填空题 (7分)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)Z的氢化物(H2Z)与乙醇互溶,而H2Y在乙醇中溶解度较小,其原因是。
(2)Y与Z形成YZ42-的空间构型为。
(3)X与Y所形成化合物晶体的晶胞如图所示。
①在一个晶胞中,X离子的数目为;
②若该化合物的密度为ag·cm-3,则晶胞的体积是
cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
参考答案:(1)水分子与乙醇分子之间能形成氢键(2分)(2)正四面体(1分)
(3)①4(2分)②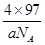 (
(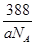 )(2分)
)(2分)
本题解析:元素X位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y是S元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,则
(1)在乙醇的水溶液中,水分子和乙醇分子之间易形成氢键,氢键的存在导致其溶解性增大,而H2S不能形成氢键。
(2)SO42-中价层电子数=4+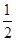 (6+2?4×2)=4,且没有孤电子对,所以是正四面体结构。
(6+2?4×2)=4,且没有孤电子对,所以是正四面体结构。
(3)①X离子数目=8×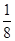 +6×
+6×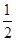 =4。
=4。
②该晶胞中X离子数目=8×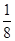 +6×
+6×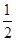 =4,Y离子数目=4,则1个晶胞的质量是
=4,Y离子数目=4,则1个晶胞的质量是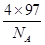 g,因此晶胞的体积是
g,因此晶胞的体积是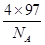 g÷ag·cm-3=
g÷ag·cm-3=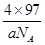 cm3。
cm3。
本题难度:一般