时间:2017-07-31 23:37:27
1、选择题 下列有关化学用语使用正确的是( )
A.NH4Br的电子式: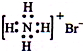
B.S2-的结构示意图: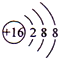
C.乙酸的分子式:CH3COOH
D.原子核内有l8个中子的氯原子:
参考答案:A.NH4Br是离子化合物,由铵根离子与溴离子构成,电子式为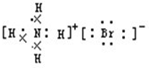
,故A错误;
B.硫离子质子数为16,核外电子数为18,最外层有8个电子,离子结构示意图为
,故B正确;
C.乙酸的分子式为C2H4O2,故C错误;
D.质量数=质子数+中子数=17+18=35,故D正确.
故选BD.
本题解析:
本题难度:一般
2、选择题 关于化学键的下列叙述中正确的是( )
A.离子化合物不含非极性共价键
B.共价化合物可能含有离子键
C.离子化合物中只含离子键
D.共价化合物不含离子键
参考答案:D
本题解析:
本题难度:一般
3、填空题 A、B、C、D、E、F六种短周期元素的原子序数依次增大.B、E同主族,C、F也同主族,B、C同周期.A与B组成的化合物甲为气态,其中A、B原子个数比为4:1.由A与C组成的两种化合物乙与丙均为液态,乙中A、C原子个数比为1:1,丙中A、C原子个数比为2:1.一个D+离子中含有10个电子,D与C可以组成阳离子与阴离个数比为2:1,且相对分子质量为78的化合物丁.回答下列问题:
(1)甲、丁的电子式:甲______,丁______;BC2的结构式______;F离子的结构示意图______.
(2)①原子半径:D______E(填“>”或“<”,下同),
②最高价氧化物对应水化物的酸性:B______E,
③稳定单质的熔点:B______C.
(3)BC2属于______晶体,EC2属于______晶体(填:原子、分子、离子、金属).
(4)由A、C、D组成的常见化合物中含有的化学键有______.
(5)乙的水溶液与FC2反应的化学方程式______.
参考答案:A、B、C、D、E、F六种短周期元素的原子序数依次增大.D+离子中含有10个电子,则D为Na元素;D与C可以组成阳离子与阴离个数比为2:1,且相对分子质量为78的化合物丁,C的原子序数小于钠元素,故化合物丁为Na2O2,C为氧元素;A与B组成的化合物甲为气态,B、C同周期,其中A、B原子个数比为4:1,化合物甲为CH4,A为氢元素、B为碳元素;由A与C组成的两种化合物乙与丙均为液态,乙中A、C原子个数比为1:1,则乙为H2O2,丙中A、C原子个数比为2:1,则丙为H2O;B、E同主族,则E为Si元素;C、F也同主族,则F为硫元素,
(1)甲为CH4,电子式为 .丁为Na2O2,电子式为
.丁为Na2O2,电子式为 ;CO2的结构式为:O=C=O;硫离子的结构示意图为
;CO2的结构式为:O=C=O;硫离子的结构示意图为 ,
,
故答案为: ;
; ;O=C=O;
;O=C=O; ;
;
(2)①同周期自左而右原子半径减小,故原子半径:Na>Si,
故答案为:>;
②同主族自上而下非金属性减弱,非金属性越强最高价含氧酸的酸性越强,故酸性H2CO3>H2SiO3,
故答案为:>;
③常温下,碳单质为固体,氧气为气体,故稳定单质的熔点:碳>氧气,
故答案为:>.
(3)CO2属于分子晶体,SiO2属于原子晶体,
故答案为:分子;原子;
(4)由A、C、D组成的常见化合物为NaOH,NaOH中含有离子键、共价键,
故答案为:离子键、共价键;
(5)H2O2有强氧化性,与SO2反应生成硫酸,反应化学方程式为:H2O2+SO2=H2SO4,
故答案为:H2O2+SO2=H2SO4.
本题解析:
本题难度:一般
4、选择题 已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
A.元素A、B组成的化合物常温下一定呈气态
B.工业上常用电解法制备元素C、D、E的单质
C.化合物AE与CE具有相同类型的化学键
D.一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应
参考答案:B
本题解析:
本题难度:简单
5、选择题 化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
[ ? ]
A.CO2的电子式
B.Cl-的结构示意图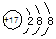
C.乙烯的结构简式C2H4
D.羧基的结构简式-HOOC
参考答案:B
本题解析:
本题难度:简单