时间:2017-07-31 23:34:11
1、选择题 有关化学键的下列叙述中正确的是( )
A.由两种元素组成的共价化合物分子,只存在极性键
B.不同种非金属元素原子之间形成的化学键都是极性键
C.离子化合物一定不含共价键
D.共价化合物可能不含离子键
参考答案:B
本题解析:
本题难度:简单
2、选择题 现代无机化学对硫?氮化合物的研究是最为活跃的领域之一。如图是已经合成的最著名的硫?氮化合物的分子结构。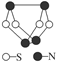
下列说法正确的是( )
A.该物质的分子式为SN
B.该物质的分子中所有原子的最外层都达到8电子稳定结构
C.含有1 mol的该物质的微粒中含有共价键为8NA
D.该物质与化合物S2N2互为同位素
参考答案:B
本题解析:它的分子式应为S4N4;有1 mol的该物质的微粒中含有共价键为10NA;同位素是针对原子而言的。
本题难度:一般
3、填空题 写出下列物质的电子式:
(1)、MgCl2______?(2)、N2______? (3)、Br2______?(4)、CH4______.
参考答案:(1)镁失去2个电子形成阳离子,氯原子得到电子形成阴离子,电子式为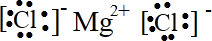
,
故答案为: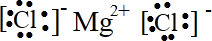
;
2)氮原子间形成三对共用电子对,电子式为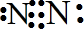
,
故答案为: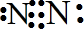
;
(3)溴最外层有7个电子,形成一对共用电子对,电子式为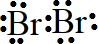
,
故答案为: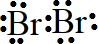
;
(4)碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为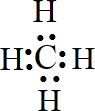
,
故答案为: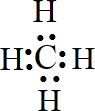
.
本题解析:
本题难度:一般
4、选择题 下列说法中正确的是
A.P4和CH4都是正四面体分子且键角都为109o28ˊ
B.CO2、NH3、BF3分子中所有原子的最外层电子都满足了8e-稳定结构
C.具有共价键的晶体叫做原子晶体,一定具有高的熔、沸点及硬度
D.H—F的键能为568 kJ/mol,H—Cl的键能为431.8 kJ/mol,这可以说明HF分子比HCl分子稳定
参考答案:D
本题解析:在P4中键角是60°,A不正确。NH3、BF3分子中氢原子和硼原子没有满足8e-稳定结构,B不正确。具有共价键的晶体不一定是原子晶体,也可能是分子晶体。
原子间以共价键相互结合,向空间无限扩展形成空间网状结构的晶体才是原子晶体,C不正确。键能越大,化学键越牢固,形成的分子越稳定,所以答案是D。
本题难度:一般
5、选择题 下列说法正确的是
[? ]
A.熔化状态下能导电的物质一定是离子化合物
B.离子化合物均能溶于水
C.离子化合物不可能由非金属元素组成
D.共价化合物中一定不含离子键
参考答案:D
本题解析:
本题难度:简单