时间:2017-07-31 23:34:11
1、填空题 将下列粒子的符号填入相应的空格内:O2、NH3、CO2、H2O、N2、(NH4)2SO4、SiCl4。
(1)存在极性键的极性分子是____。
(2)存在非极性键的非极性分子是____。
(3)存在极性键的非极性分子是____。
(4)全部由非金属元素组成的离子化合物是____。
参考答案:(1)NH3、H2O
(2)O2、N2
(3)CO2、SiCl4
(4)(NH4)2SO4
本题解析:
本题难度:一般
2、选择题 PH3是一种无色剧毒气体,其分子结构和NH3相似,但P—H键键能比N—H键键能低。下列判断正确的是? ( )。
A.PH3分子呈平面三角形
B.PH3分子是极性分子
C.PH3沸点低于NH3沸点,因为P—H键键能低
D.PH3分子稳定性低于NH3分子,因为NH3分子之间存在氢键
参考答案:B
本题解析:PH3分子呈三角锥形,空间结构不对称,属于极性分子,A错、B对;PH3沸点低于NH3沸点,因为NH3分子间存在氢键,C错;PH3分子稳定性低于NH3分子,因为P—H键键能比N—H键键能低,D错。
本题难度:简单
3、选择题 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)( )
A.分子中含有6个手性碳原子
B.不能与氯化铁溶液发生显色反应
C.一定条件下能发生酯化反应和消去反应
D.1mol洋蓟素最多可与11molNaOH反应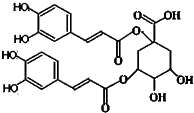
参考答案:A、根据题意信息,分子中含有4个手性碳原子,故A错误;
B、分子中有酚羟基,能和氯化铁溶液发生显色反应,故B错误;
C、分 子中的醇羟基能发生酯化反应和消去反应,故C正确;
D、1mol洋蓟素中含有酚羟基4mol,消耗氢氧化钠4mol,含有酯基2mol,能消耗氢氧化钠2mol,含有羧基1mol,能和1mol氢氧化钠反应,1mol洋蓟素最多可与7molNaOH,故D错误.
故选C.
本题解析:
本题难度:简单
4、填空题 碳、氮、氧是地球上丰富的元素。
(1)C、N、O的第一电离能由大到小的顺序为(用元素符号表示)_________。
(2)前四周期元素中,基态原子未成对电子数与氮相同的元素有_________种。
(3)试判断NH3溶于水后,形成NH3·H2O的合理结构:_______(填字母代号),推理依据是____ ___________。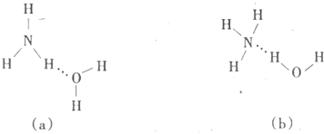
(4)H2O分子与H+结合的过程中未发生改变的是_________(填序号)。
a.微粒的空间构型? b.O原子的杂化方式? c.H—O—H的键角
(5)C60晶体(其结构模型如图)中每个C60分子周围与它距离最近且等距离的C60分子有__________个。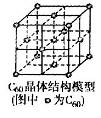
参考答案:(8分)(1)N、O、C(1分) (2)4(2分)
(3)b(1分);一水合氨电离产生NH4+和OH-(1分) (4)b(1分) (5)12(2分)
本题解析:(1)同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以C、N、O的第一电离能由大到小的顺序为N>O>C。
(2)氮元素核外电子排布是1s22s22p3,所以基态原子未成对电子数是3个,因此前四周期元素中,基态原子未成对电子数与氮相同的元素有P、V、Co、As,共计是4种元素。
(3)因为一水合氨在溶液中能电离产生NH4+和OH-,因此在其结构中氮元素与水中的氢元素形成氢键,所以正确的结构是b,答案选b。
(4)H2O分子与H+结合形成水合氢离子,其空间构型由V形变为三角锥形,因此微粒的空间构型、H—O—H的键角均发生变化,但O原子的杂化方式不变,仍然是sp3杂化,答案选b。
(5)根据C60晶胞结构可知,每个C60分子周围与它距离最近且等距离的C60分子位于面心处,共计有3×8÷2=12个。
本题难度:一般
5、选择题 下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2===CH2 ③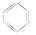 ④CH≡CH?⑤NH3 ⑥CH4
④CH≡CH?⑤NH3 ⑥CH4
A.①②③
B.①⑤⑥
C.②③④
D.③⑤⑥
参考答案:A
本题解析:①②③都是平面性结构,所以中心原子都是sp2杂化;乙炔是直线型结构,碳原子是sp杂化;氨气是三角锥形,甲烷是正四面体型结构,所以中心原子都是sp3杂化,答案选A。
本题难度:一般