时间:2017-07-27 11:15:22
1、选择题 下列有关化学研究的正确说法是( ? )
A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.依据丁达尔现象可将分散系分为溶液、胶体与浊液
D.从H2S、HCl的酸性:H2S<HCl,可以推出非金属性:S<Cl
2、填空题 “西气东输”工程使北京用上了更加清洁的能源--天然气(主要成分是CH4)。在使用天然气以前北京用的煤气主要是将碳与水蒸气在高温下反应制得的水煤气,水煤气的主要成分是CO和H2,两者的体积比约为
1:1。 已知:CO的燃烧热△H=-283.0 kJ/mol;H2的燃烧热△H=-286.0 kJ/mol;CH4的燃烧热△H=-890.0 kJ/mol。
(1)用H2为原料设计成氢氧燃料电池(电解质溶液为KOH),正极的电极反应式是:_______________。
(2)已知: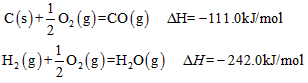
写出由C(s)与H2O(g)反应生成水煤气的热化学方程式:______________________。
(3)忽略水煤气中其它成分,若获得相等的热量,所需相同状况下水煤气与甲烷的体积比约为_______;排放的CO2物质的量的比约为_________。通过计算得知:使用天然气能______(填“增多”或“减少”)温室气体(CO2)的排放。(各种燃料均完全燃烧)
(4)若将由amolCH4、CO和H2组成的混合气体完全燃烧,生成CO2气体和液态水时放出热量(Q)的取值范围是___________。
3、填空题 热化学方程式中的H实际上是热力学中的一个物理量,叫做焓。一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态)。
(1)化学反应中的ΔH是以_______?的形式体现的。对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为____0(填“大于”.“小于”),该反应是?_____(填“放热”或“吸热”)反应。?
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关。?
已知:298K时,
H2(g)+Cl2(g)=2HCl(g)?ΔH=?-185?kJ/mol?ΔH(H2)=?436?kJ/mol, ΔH(Cl2)=?247?kJ/mol。?则ΔH(HCl)=?________________。
(3)Hess?G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)?ΔH?=?-25?kJ/mol?
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)?ΔH?=?-47?kJ/mol?
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)?ΔH?=?+19?kJ/mol
请写出CO还原FeO的热化学方程式_______________________。?
4、选择题 已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) ΔH=-2878 kJ·mol-1
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) ΔH=-2869 kJ·mol-1,
下列说法正确的是
[? ]
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
5、选择题 在常温常压下,已知:
4Fe(s)+3O2(g)=2Fe2O3(s) △H1
4Al(s)+3O2(g)=2Al2O3(s) △H2
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △H3
则△H3与△H1和AH2间的关系正确的是
[? ]
A.△H3=1/2(△H1+△H2)
B.△H3=△H2 -△H1
C.△H3 =2(△H2+△Hl)
D.△H3=1/2(△H2-△H1)