时间:2017-07-27 11:12:06
1、填空题 能源是影响全球经济和生活的重要因素。目前人类已开发和利用的能源中,氢气是最理想的清洁能源之一。已知反应:2H2+O2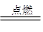 2H2O,试回答下列问题。
2H2O,试回答下列问题。
(1)该反应为 反应(填“吸热”或“放热”);
(2) 1当生成8g H2O时,H2O的物质的量是 (填字母代号)。
A.1mol B.1mol/L C.1g/mol
参考答案:(1)放热 (2)A
本题解析:(1)氢气燃烧是放热反应,所以该反应为放热反应。
(2) 1当生成8g H2O时,H2O的物质的量为1mol,故选A
本题难度:一般
2、选择题 室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如下图所示。下列说法正确的是(?)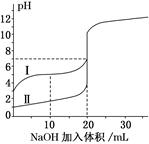
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH)=10.00 mL 时,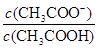 >1
>1
C.pH=7时,两种酸所用NaOH溶液的体积相等
D.V(NaOH)=20 .00 mL 时,c(Cl-)<c(CH3COO-)
参考答案:B
本题解析:醋酸是弱电解质,0.100 mol/L的盐酸和醋酸,后者的pH大,有纵坐标判断A不正确;V(NaOH)=10.00 mL 时,溶液中的溶质CH3COOH和CH3COONa,不考虑水解和电离时,二者的物质的量比为1∶1,相同温度和浓度时,CH3COOH的电离大于CH3COO-的水解,B正确;pH=7时,盐酸所用NaOH溶液的体积大,C不正确;V(NaOH)=20 .00 mL 时,两溶液中的溶质分别是NaCl和CH3COONa,且二者的物质的量相等,考虑CH3COO-水解,故c(Cl-)>c(CH3COO-),D不正确。
本题难度:一般
3、填空题 (10分)某温度(t℃)时,水的离子积为KW=1×10-13,则该温度(填“大于”、“小于”或“等于”)________25℃。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
①若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是________________?。
②若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是_______?_。
参考答案:
大于;①10:1;c(Na+)>c(SO42-)>c(H+)=c(OH-);②9:2;c(H+)> c(SO42-) > c(Na+) > c(OH-)
本题解析:略
本题难度:一般
4、计算题 (8分)某温度(t℃)时,水的KW=10-13,则该温度(填大于、等于或小于)
(1)_____25℃,理由是_________________________________________________,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(2)若所得混合溶液为中性,则a:b=_________;
(3)若所得混合溶液pH=2,则a:b=__________。
参考答案:(1)大于;水的电离吸热,升高温度,促进水的电离,KW增大
(2)10:1?(3)2:9
本题解析:(1)25℃时水的离子积常数是10-14,如果水的KW=10-13,则温度一定大于25℃.因为电离是吸热的,所以加热促进水的电离,离子积常数增大。
(2)此温度下pH=11的NaOH溶液的浓度是0.01mol/L。所得混合溶液为中性,说明氢离子的物质的量和OH-物质的量相等,即a×10-2=b×10-1,解得a︰b=10︰1。
(3)所得混合溶液pH=2,说明硫酸是过量的,因此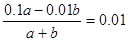 ,解得a︰b=2︰9。
,解得a︰b=2︰9。
本题难度:一般
5、填空题 (12分)在温度T ℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
参考答案:(12分)(每空2分) (1)大于 1×10-12 ? 2)4 5×10-5mol/L? (3)4 1×10-4mol/L
本题解析:(1)Kw=c(H+)c(OH-)=10-a×10-b=10-(a+b)=10-12,故温度大于25℃;
(2)pH=8,c(OH-)==10-4mol/L,故氢氧化钡的浓度为5×10-5mol/L;
(3)pH=7,在该温度下溶液呈碱性,c×4ml=10-5×20ml,c=5×10-5mol/L;又因为c=,c(H+)=10-4mol/L;pH=4。
本题难度:一般