时间:2017-07-27 10:50:11
1、实验题 ( 16分)某兴趣小组拟利用如下图装置探究验证干燥的Cl2和潮湿的C l2有无漂白性。
l2有无漂白性。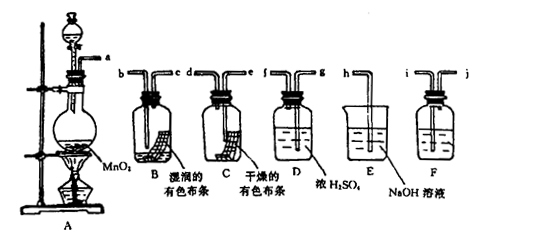
回答下列问题:
(1)A装置中的主要玻璃仪器有:导管、酒精灯、圆底烧瓶、?。
A装置中发生反应的化学方程式是?。
F装置中的试剂应为?,作用为?。
(2)按气体从左向右流向将各装置依次连接起来(填接口标号): a?接?,
?接?,?接?,?接?,?接 ?。
?。
(3)通入Cl2后,从集气瓶A、B中 红色布条的现象可得出的结论是?
红色布条的现象可得出的结论是?
?;其中发生的反应的化学方程式为?。
(4)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是?
?。
(5)烧杯E中发生反应的化学方程式为?。
(6)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛4 mol·L-1的NaOH溶液的体积至少应为?mL。
参考答案:( 16分)
16分)
(1)分液漏斗;MnO2+4HC(浓) MnCl2+2H2O+Cl2↑ ;饱和食盐水;除Cl2中的HCl
MnCl2+2H2O+Cl2↑ ;饱和食盐水;除Cl2中的HCl
(方程式2分,其余每空1分,共5分)
(2)a 接i,j接g,f接e,d接b,c接h ?(2分,全对才得分)
(3)干燥的Cl2没有漂白性,氯水有漂白性?(1分)
Cl2+ H2O="HCl+" HClO?(2分)
(4)验证稀盐酸是否有漂白性?(1分)
(5)吸收多余的Cl2?(1分)
Cl2+2NaOH="NaCl+" NaClO+H2O?(2分)
(6)100?(2分)
本题解析:略
本题难度:一般
2、填空题 (10分)利用化学原理可以对工厂排放的废水进行有效检测和合理处理。
(1)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润红色石蕊试纸变蓝的气体)。除去NO2-离子的离子方程式是?
?▲?。
(2)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将Ca(OH)2或CaO投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7mol/L时,溶液中c(PO43-)=? ▲?
(已知常温时,KSP[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石——鸟粪石,反应的方程式为Mg2++ NH4++ PO43-= MgNH4 PO4。该方法中需要控制污水的pH为7.5-10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能是?▲?。与方法一相比,方法二的优点是? ▲??。
(3)三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下: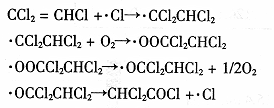
该反应的总化学方程式为? ▲?。
参考答案:(1)2Al+OH-+NO2-+2H2O=2AlO2-+NH3?H2O
(2)①5×10-7
②当pH高于10.7时,溶液中的NH4+、Mg2+会与OH—反应
能充分除去废水中的氮,充分利用镁矿工业的废水。
(3)2CCl2=CHCl+O2=2CHCl2COCl
(每空2分,共10分)
本题解析:(1)由题信息可得,生成使湿润红色石蕊试纸变蓝的气体为NH3,所以反应的离子方程式为:2Al+OH-+NO2-+2H2O=2AlO2-+NH3?H2O
(2)①KSP[Ca3(PO4)2]=c(Ca2+)3×c(PO43-)2=(2×10-7)2×c(PO43-)2得,c(PO43-)=5×10-7;
②pH高于10.7,鸟粪石的产量会大大降低,其原因可能是:溶液中的NH4+、Mg2+会与OH—反应
与方法一相比,方法二的优点是:能充分除去废水中的氮,充分利用镁矿工业的废水。
(3)根据反应机理,将方程式叠加得该反应的总化学方程式为:2CCl2=CHCl+O2=2CHCl2COCl
本题难度:一般
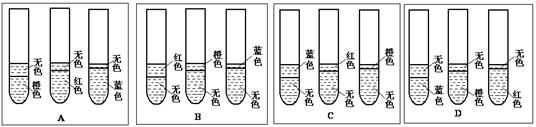
3、实验题 (5分)为了探究乙酸乙酯水解的条件,做了如下实验
步骤一:取三支相同的试管编号为1、2、3,各试管内依次加入下列药品
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL蒸馏水 | 4 mL 蒸馏水 +3滴浓H2SO4 | 4 mL 蒸馏水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL饱和食盐水 | 4 mL饱和食盐水 +3滴浓H2SO4 | 4 mL饱和食盐水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
参考答案:(5分)
(1)A?(1分)
(2)高温下乙酸乙酯挥发 (1分)?
(3) 乙酸乙酯在水溶液中形成乳浊液?(1分)
(4)有机层和水层接触面太小(1分)
(5)乙酸乙酯在水中和电解质溶液中溶解度相差较大,改用饱和食盐水后大大减少了乙酸乙酯的溶解。(1分)
本题解析:(1)实验1中的乙酸乙酯不水解,所以下层仍是橙色,上层为无色的乙酸乙酯;实验2中加入稀硫酸,乙酸乙酯水解后的溶液呈酸性,酸使甲基橙变红色,所以下层是红色,上层是无色;实验3加入氢氧化钠,乙酸乙酯水解后的溶液呈碱性,所以碱遇石蕊变蓝色,下层是蓝色,上层是无色,答案选A。
(2)乙酸乙酯的沸点较低,温度过高,造成乙酸乙酯的挥发损失;
(3)乙酸乙酯微溶于水,振荡后形成乳浊液使溶液显浑浊;
(4)乙酸乙酯微溶于水,所以有机层和水层接触面太小,反应速率慢;
(5)改进的实验与原来相比,差别在于加入了饱和食盐水,说明乙酸乙酯在水中和电解质溶液中溶解度相差较大,改用饱和食盐水后大大减少了乙酸乙酯的溶解。
本题难度:一般
4、实验题 (12分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________所致。
(3)设计实验并验证?
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
a.酚酞试液?b.CCl4 ?c.无水酒精?d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| ? | 选用试剂 | 实验现象 |
| 方案1 | ? | ? |
| 方案2 | ? | ? |
参考答案:(2)①Br2 ②Fe3+ (3)d 溶液呈红色 b CCl4层呈无色
(4)①2Fe2++Br2===2Fe3++2Br- ②1.2 mol/L
本题解析:略
本题难度:一般
5、填空题 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HC1挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。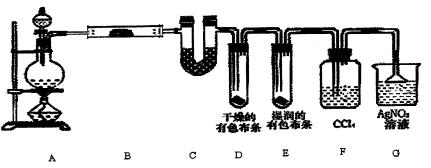
(1)若用含有0.2 mol HC1的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是?。
(2)①装置B中盛放的试剂名称为?,作用是?。
装置C中盛放的试剂名称为?,作用是? ?。
?。
②装置D和E中出现的不同现象说明的问题是?。
③装置F的作用是____?。
④写出装置G中发生反应的离子方程式?。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在?与?之间(填装置字母序号),装置中应放入?(填写试剂或用品名称)
参考答案:

本题解析:略
本题难度:一般