时间:2017-07-27 10:48:01
1、选择题 下列物质能与金属镁发 生反应,并产生氢气的是
生反应,并产生氢气的是
A.氯化铵溶液
B.浓硝酸
C.热的苯
D.氯化铝溶液
参考答案:AD
本题解析:略
本题难度:简单
2、填空题 以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下: 
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp= 1.8×l0-11,若溶液中c(OH-) =3.0×10-6mol/L,则溶液中c(Mg2+)=_____
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为____
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO20.896 L,通过计算确定碱式碳酸镁的化学式。_____________________________
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数____(填“升高”、“降低”或“不变”)。
参考答案:(1)2.0 mol/L
(2)NH4Cl
(3)
n(MgO):n(CO2):n(H2O)=5.00×10-2:4.00 ×10-2:5.00×10-2 =5:4:5 ,碱式碳酸镁的化学式为:Mg(OH)2·4MgCO3·4H2O
(4)升高
本题解析:
本题难度:一般
3、选择题 将两种金属混合而成的粉末30 g,与足量的盐酸反应,产生氢气22.4 L,该混合物可能是(?)
A.镁和铜
B.钠和锌
C.铁和钙
D.铝和镁
参考答案:A
本题解析:由极限法分析:若全部为选项中某金属产生氢气22.4 L所消耗的质量分别为:镁24 g、钠46 g、锌65 g、铁56 g、钙40 g、铝18 g,铜不反应可认为需要无穷大的质量,混合物30 g就可产生同样量的气体,一定含有镁,答案为A。
本题难度:简单
4、选择题 向20 mL MgSO4和Al2(SO4)3的混合液中逐滴加入一定浓度的NaOH溶液,当加到25 mL时,沉淀量最大。再继续向溶液中滴加NaOH溶液时,沉淀逐渐溶解,加到30 mL时,沉淀不再溶解,则原混合液中MgSO4和Al2(SO4)3的物质的量浓度之比为
(? )
A.2∶1
B.5∶1
C.3∶2
D.1∶1
参考答案:A
本题解析:Al(OH)3+OH-====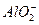 +2H2O
+2H2O
5? 5
Al3+?+? 3OH-====Al(OH)3↓
5? 15? 5
Mg2++2OH-====Mg(OH)2↓
5? (25-15)
=10
故c(Mg2+)∶c(Al3+)=1∶1
c(MgCl2)∶c〔Al2(SO4)3〕=2∶1
本题难度:简单
5、选择题 有100mL3.5mol/LNaOH溶液和100mL1mol/L的AlCl3溶液, 按照如下两种方法进行实验:① 将氢氧化钠溶液逐滴加到氯化铝溶液中;② 将氯化铝溶液逐滴加到氢氧化钠溶液中。 比较两次实验的结果是 (?)
A.现象不同, 沉淀量相等
B.现象不同, 沉淀量不同
C.现象相同, 沉淀量不同
D.现象相同, 沉淀量相同
参考答案:A
本题解析:略
本题难度:简单