时间:2017-07-27 10:48:01
1、填空题 Al及其化合物在工业上有极其广泛的用途,
(1)焊接钢轨时用Al冶炼Fe的反应方程式为?;铝的化合物明矾可用于净水,其原理用离子方程式解释为?。
(2)硅藻遗骸中主要成分是Al2O3、SiO2和Fe2O3。从中获取Al(OH)3的过程如下:
步骤I:取适量硅藻遗骸用70%H2SO4浸泡;
步骤II:向上述浸泡液中加入过量NaOH并过滤;
步骤III:向上述滤液中通入过量CO2过滤得到Al(OH)3。
①用70%H2SO4浸取硅藻遗骸的目的是?。
②步骤II中涉及铝元素的离子方程式为?;
③步骤III中能否用HCl代替CO2??(填“能”或“不能”);该步骤所得滤液中存在的电荷守恒式为?;向该滤液中滴加少量NaOH溶液,则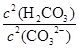 ?填(“变大”、“变小”或“不变”)
?填(“变大”、“变小”或“不变”)
(3)Al(OH)3可用作阻热材料,试从Al(OH)3的化学性质角度分析其原因?。
参考答案:
(1)Fe2O3+2Al Al2O3+2Fe(2分)? Al3++3H2O=Al(OH)3(胶体)+3H+(2分)
Al2O3+2Fe(2分)? Al3++3H2O=Al(OH)3(胶体)+3H+(2分)
(2)①从硅藻遗骸中浸取出Al3+和Fel3+(1分)
②Al3++4OH-=AlO2-+2H2O(或Al3++3OH-=Al(OH)3↓? Al(OH)3+OH-=AlO2-+2H2O)( 2分)
③不能(1分) c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+2c(SO42-)(2分)?变小(1分)
(3)Al(OH)3的分解反应为吸热反应
本题解析:本题是通过工业上Al及其化合物在工业上的用途以及Al(OH)3的分离与制备。
(1)一个是铝热反应的用途—焊接钢轨或者用来冶炼金属,可溶性铝盐净水,主要是利用Al3+的水解
得到Al(OH)3(胶体)吸附悬浮物达到净水的目的。Fe2O3+2Al Al2O3+2Fe,Al3++3H2O=Al(OH)3(胶体)+3H+。这两个方程式注意条件,前面是高温,后面需注意用“=”号并且要写 “胶体”二字。
Al2O3+2Fe,Al3++3H2O=Al(OH)3(胶体)+3H+。这两个方程式注意条件,前面是高温,后面需注意用“=”号并且要写 “胶体”二字。
(2) 通过从Al2O3、SiO2和Fe2O3中获取Al(OH)3:用H2SO4浸泡溶解Al2O3和Fe2O3,剩余SiO2,然后进行过滤得到固体(SiO2)和滤液(Al3+和Fel3+,SO42-等)。然后向上述浸泡液中加入过量NaOH后得到Fe(OH)3↓和NaAlO2和NaOH的混合溶液并进行过滤。在往上述滤液中通入过量CO2过滤得到Al(OH)3↓和NaHCO3溶液。
①用70%H2SO4浸取硅藻遗骸的目的是使Al2O3、Fe2O3溶解,从硅藻遗骸中浸取出Al3+和Fel3+
②步骤II中涉及铝元素的离子方程式为Al3++4OH-=AlO2-+2H2O(或Al3++3OH-=Al(OH)3↓? Al(OH)3+OH-=AlO2-+2H2O),Al3+与OH-的反应与量有关。
③步骤III中不能用HCl代替CO2;HCl不好控制用量,HCl过量Al(OH)3↓会溶解,HCl少量,AlO2-不能完全沉淀。该步骤所得滤液中存在的离子有:阳离子:Na+、 H+?阴离子:CO32-、HCO3-、OH-、SO42-。根据电荷守恒即有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+2c(SO42-)。向该滤液中滴加少量NaOH溶液,消耗H2CO3、CO32-增大,所以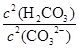 =
=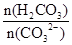 比值变小
比值变小
(3)Al(OH)3可用作阻热材料,利用Al(OH)3受热分解,使温度降低。3的分离与制备,物质分离,方程式书写等结合在一起考查
本题难度:一般
2、填空题
SiO2属于酸性氧化物,实验室里盛放碱液的玻璃试剂瓶不能用玻璃塞,而常用橡皮塞是因为(用离子方程式表示)_________________________; 玻璃瓶也不能盛装氢氟酸是因为(用化学方程式表示)
_____________________。铝制餐具不宜长时间存放碱性食物的原因是(用离子方程式表示)
?________________________。
参考答案:2OH-+SiO2==SiO32-+H2O; SiO2+4HF==SiF4↑ +2H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑
本题解析:
本题难度:一般
3、选择题 用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释不正确的是
[? ]
参考答案:B
本题解析:
本题难度:一般
4、选择题 镁、铝都是较活泼的金属,下列描述不正确的是( )
A.镁和铝的单质都能在氧气中剧烈燃烧,并放出耀眼的光芒
B.铝能和稀盐酸、稀硫酸、强碱反应
C.镁在加热的条件下可以跟二氧化碳反应,铝在一定条件下可以跟氧化铁发生置换反应
D.铝热反应是镁条、铝粉和氧化铁的混合物发生的反应
参考答案:A、金属镁和铝的单质具有强还原性,能与氧气在点燃时发生剧烈的燃烧反应,并放出耀眼的光芒,故A正确;
B、铝既能与酸(非强氧化性酸)又能与强碱反应氢气,则铝能和稀盐酸、稀硫酸、强碱反应,故B正确;
C、镁与二氧化碳加热反应生成氧化镁和碳,置换反应是单质与化合物反应生成新单质和新化合物,则铝与氧化铁高温生成铁和氧化铝为置换反应,故C正确;
D、因铝热反应为铝与某些金属氧化物的反应,镁条是用来引发铝热反应的物质,故D错误;
故选D.
本题解析:
本题难度:简单
5、选择题 两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温、同压下放出气体的体积比为1:2,则两份铝片的质量之比为( )
A.1:1
B.2:3
C.3:2
D.1:2
参考答案:铝片和盐酸或烧碱反应中,酸、碱均足量,
由2Al~3H2↑,则铝片质量相同,则产生的氢气的体积和物质的量均相同,
则同温、同压下放出气体的体积比为1:2,即两份铝片的物质的量之比为1:2,其质量之比为1:2,
故选D.
本题解析:
本题难度:简单