时间:2017-07-27 10:48:01
1、选择题 铝在人体内积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为“食品污染源之一”而加以控制。铝在下列使用场合须加以控制的是(? )
①制铝锭?②制易拉罐?③制电线电缆?④制牙膏皮?⑤用明矾净水?⑥制炊具?⑦用明矾和苏打作食物膨化剂?⑧用Al(OH)3制成药片治胃病?⑨制防锈油漆
A.②④⑤⑥⑦⑧
B.②⑤⑥⑦⑨
C.①②④⑤⑥⑦⑧
D.③④⑤⑥⑦⑧
参考答案:C
本题解析:需控制铝的使用的场合,主要是在食品、医药、饮用水等方面。
本题难度:简单
2、选择题 能与铝粉混合组成铝热剂的氧化物是(?)
A.SiO2
B.MgO
C.Al2O3
D.Fe2O3
参考答案:D
本题解析:略
本题难度:简单
3、实验题 铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+?=□Fe(OH)3↓+□C1-+?
②检验滤液B中是否还含有铁元素的方法为:??(注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为?(填代号)。
a.氢氧化钠溶液? b.硫酸溶液? c.氨水? d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、?(填操作名称)、洗涤。
(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:2Al+3HO2-=2AlO2-+OH-+H2O
①正极反应式为?。
②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的?
原因之一,电极被腐蚀的离子方程式为?。
(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在)。不采用氯化铝溶液的原因是?。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为?(填代号)。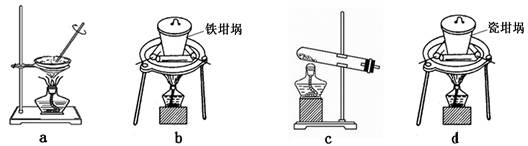
参考答案:(14分)(1)①2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+(2分)
②取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。
(其他合理答案均得分)(2分)?③ c(1分)?④过滤(1分)
(2)①HO2-+2e-+H2O=3OH-(2分)?②2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(3)氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气(2分)?(4)b(2分)
本题解析:(1)①根据方程式可知,铁元素的化合价从+2价升高到+3价,失去1个电子。氯元素的化合价从+1价,降低到-1价,得到2个电子,则根据电子的得失守恒可知,还原剂与氧化剂的物质的量之比是2:1。根据原子守恒与电荷守恒可知,反应前有水参加,反应后有氢离子生成,因此配平后的方程式是2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+。
②由于铁离子能和KSCN溶液发生显色反应,可以鉴别铁离子。而亚铁离子检验还原性,能被氯水氧化生成铁离子,据此可以鉴别滤液B是否含有铁元素。即取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。
③滤液B中的铝元素以Al3+的形式存在,要以沉淀形式析出,需要加入碱液。由于氢氧化铝是两性氢氧化物,所以不能选择强碱,最好选择弱碱氨水,答案选c。
④冷却结晶后有晶体析出,因此分离出晶体的实验操作应该是过滤。
(2)①原电池中负极,失去电子,正极得到电子。则根据方程式2Al+3HO2-=2AlO2-+OH-+H2O可知,负极是铝失去电子,正极是HO2-得到电子,所以正极的电极反应式是HO2-+2e-+H2O=3OH-。
②金属铝能被氢氧化钠溶液溶解,生成偏铝酸钠和氢气,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。
(3)铝是活泼的金属,金属活动顺序表中位于氢的前面,在氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气,Al3+不放电,得不到金属铝。
(4)a是蒸发。不能熔融二氧化硅和氢氧化钠,不正确;b是铁坩埚,可以熔融二氧化硅和氢氧化钠,正确;c是试管,不能熔融二氧化硅和氢氧化钠,不正确;d是瓷坩埚,瓷坩埚中含有二氧化硅能和氢氧化钠反应,不能熔融氢氧化钠,不正确,答案选b。
本题难度:一般
4、选择题 用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释不正确的是
A.铝在空气中能很快形成氧化膜
B.金属铝活动性较弱,不能在空气中燃烧
C.氧化铝的熔点比铝高
D.氧化铝薄膜包住了熔化的铝
参考答案:B
本题解析:将铝箔用坩埚钳夹住放在酒精灯火焰上加热,铝和氧气反应生成了氧化铝,又因三氧化二铝的熔点高于铝的熔点,而三氧化二铝在铝的表面,所以加热铝箔的时候铝熔化了但是不会滴落.B错误。
本题难度:一般
5、选择题 将50mL某未知浓度的AlCl3溶液分别加到60mL1mol/LNaOH溶液或是60mL3mol/LNaOH溶液中,均能得到1.56gAl(OH)3沉淀,则AlCl3溶液的浓度可能是
A.0.4mol/L
B.0.5mol/L
C.0.6mol/L
D.1mol/L
参考答案:D
本题解析:解:1.56gAl(OH)3沉淀,其物质的量为1.56g/78g/mol=0.02mol,
①由加到60mL1mol/LNaOH溶液中只发生Al3++3OH-═Al(OH)3↓,
碱完全反应,则AlCl3溶液的浓度应≥0.02mol/0.05L=0.4mol/L,
②由加到60mL3mol/LNaOH溶液中发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,
设此AlCl3溶液的溶质的物质的量为x,则
Al3++3OH-═Al(OH)3↓
x? 3x? x
Al(OH)3+OH-═AlO2-+2H2O
x-0.02? x-0.02
根据消耗的碱的物质的量可知,3x+(x-0.02)=0.06×3,
解得x=0.05mol,
此AlCl3溶液的浓度为0.05mol/0.05L=1mol/L,
由①②可知,此AlCl3溶液的浓度为1mol/L,故选D.
点评:本题考查铝离子与碱的反应,明确碱的物质的量对发生的化学反应的影响、氢氧化铝的能溶于强碱时解答本题的关键,难度不大.
本题难度:一般