时间:2017-07-27 10:48:01
1、选择题 下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是
①NaHCO3?②Al2O3?③Al(OH)3?④Al
A.③④
B.②③④
C.①③④
D.全部
参考答案:D
本题解析:能与酸反应又能与碱反应的物质有:弱酸铵盐、弱酸酸式盐、氨基酸、蛋白质、酯、铝、氧化铝、氢氧化铝等;
本题难度:一般
2、选择题 现有铝和过氧化钠的固体混合物样品,加入稀盐酸使混合物完全溶解,所得溶液c(Al3+)∶c(H+)∶c(Cl-)=1∶2∶8,则原固体混合物中铝元素与氧元素的质量比为(? )
A.3∶4
B.9∶32
C.9∶16
D.9∶8
参考答案:C
本题解析:2Al+6HCl=2AlCl3+3H2↑;2Na2O2+4HCl=4NaCl+2H2O+O2↑.由于c(Al3+)∶c(H+)∶c(Cl-)=1∶2∶8,所以溶液中含有的各物质的物质的量之比为:n(AlCl3):n(HCl):n(NaCl) =1:2:3.则原固体中n(Al):n(Na2O2) =1:1.5=2:3.n(Al):n(O)=2:3×2=1:3。m(Al):m(O)="1×27:" 3×16=9:16.所以选项为:C。
本题难度:一般
3、选择题 两种金属混合粉末15g,与足量的盐酸反应时生成11.2L氢气(标准状况),符合上述情况的金属混合物的是?(?)
A.Mg和Al
B.Mg和Ag
C.Al和Zn
D.Fe和Zn
参考答案:BC
本题解析:略
本题难度:简单
4、填空题 (8分)某些铁、铝制品的表面常生成一层氧化物,其主要成分分别是氧化铁、氧化铝。请回答:
(1)两种氧化物均能与盐酸反应,生成的两种盐的化学式分别为?、?。向这两种盐的溶液中分别滴加足量氢氧化钠溶液,可观察到:其中一种溶液中的现象是先产生白色沉淀,然后白色沉淀逐渐消失;另一种溶液中的现象是____(填序号)。?
①产生白色沉淀?②产生红褐色沉淀
③产生白色沉淀,迅速变成灰绿色,最后变成红褐色
(2)铝与氧化铁的反应可用于焊接钢轨,其反应的化学方程式为?。
参考答案:(1)FeCl3? AlCl3,?②?(2)2Al + Fe2O3 ?2Fe + Al2O3
?2Fe + Al2O3
本题解析:本题考查铁、铝及其化合物的化学性质及比较,①氧化物:铁的氧化物为碱性氧化物,与酸反应生成盐和水,即Fe2O3+6H+=2Fe3++3H2O,Al2O3为两性氧化物,既能与酸、又能与碱反应,Al2O3+6H+=2Al3++3H2O;②氢氧化物,氢氧化铝为两性氢氧化物,能与碱反应,故有Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO+2H2O,先产生沉淀,后溶解;而在Fe3+里,只产生红褐色的氢氧化铁沉淀;③铝与氧化铁的反应为铝热反应,
2Al+Fe2O32Fe+Al2O3。
本题难度:一般
5、实验题 镁在高温下与O2、N2或CO2均可以发生反应,试解决下列问题。
(1)工业通常采用电解熔融氯化镁冶炼金属镁,不以氧化镁为原料的理由是?。
(2)将燃着的镁条伸入盛满CO2的集气瓶中,镁条剧烈燃烧,发出耀眼的白光,瓶内壁上有黑色物质生成,化学方程式为?。
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的反应步骤为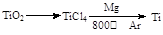
金属镁的作用为?,在Ar气氛中的进行的理由是?。
(4)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知:
Mg+H2O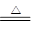 MgO+H2↑?Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
MgO+H2↑?Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示。
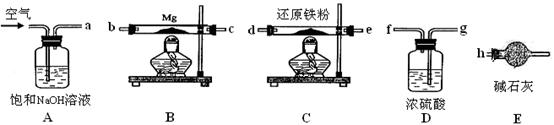
①导管口间的连接次序是:a →( )()→()()→()()→ h
②通气后,应先点燃?(填“B”或“C”)装置的酒精灯,装置A的作用是?,装置E的作用是?。
③请设计一个简单的小实验验证产物是氮化镁?。
参考答案:(1)MgO熔点很高,能耗太大
(2)2Mg+CO2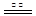 2MgO+C
2MgO+C
(3)作还原剂?氩气作保护气,防止高温下Mg(或Ti)在空气中的O2(CO2或N2)作用
(4)①a →( g )( f )→ ( d )( e )→( b )( c )→ h
②C?除去空气中的CO2?防止空气中的水蒸气进入与Mg3N2反应
③取少量产物置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。
本题解析:(1)工业通常采用电解熔融氯化镁冶炼金属镁,不以氧化镁为原料的理由是MgO熔点很高,能耗太大。(2)将燃着的镁条伸入盛满CO2的集气瓶中,镁条剧烈燃烧,发出耀眼的白光,瓶内壁上有黑色物质生成,化学方程式为2Mg+CO2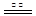 2MgO+C。(3)?金属镁的作用为作还原剂。在Ar气氛中的进行的理由是氩气作保护气,防止高温下Mg(或Ti)在空气中的O2(CO2或N2)。(4)①制备氮化镁(Mg3N2)要除去氧气和水蒸气的干扰,故连接顺序为a →( g )( f )→ ( d )( e )→( b )( c )→ h 。②通气后,应先点燃C装置的酒精灯确保把氧气除干净,装置A的作用是除去空气中的CO2。,装置E的作用是防止空气中的水蒸气进入与Mg3N2反应。 ?③由于氮化镁与水反应后能放出氨气,可以通过检测氨气的生成来测定是否有氮化镁。方法为:取少量产物置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。
2MgO+C。(3)?金属镁的作用为作还原剂。在Ar气氛中的进行的理由是氩气作保护气,防止高温下Mg(或Ti)在空气中的O2(CO2或N2)。(4)①制备氮化镁(Mg3N2)要除去氧气和水蒸气的干扰,故连接顺序为a →( g )( f )→ ( d )( e )→( b )( c )→ h 。②通气后,应先点燃C装置的酒精灯确保把氧气除干净,装置A的作用是除去空气中的CO2。,装置E的作用是防止空气中的水蒸气进入与Mg3N2反应。 ?③由于氮化镁与水反应后能放出氨气,可以通过检测氨气的生成来测定是否有氮化镁。方法为:取少量产物置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。
本题难度:一般