时间:2017-07-27 10:45:42
1、选择题 实验室现有3种酸碱指示剂,其pH变色范围如下甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0 用
0.10 mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是
[? ]
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
参考答案:D
本题解析:
本题难度:一般
2、填空题 三农问题是政府和社会关注的问题,化肥是土地的营养品.某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④…;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(1)写出步骤④中的实验内容______,写出实验步骤④中的离子方程式:______.
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是______
A.玻璃棒?B.托盘天平?C.烧杯?D.漏斗
(3)步骤⑤的实验目的是______.
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为______(填字母选项).
A.50mL,50mL?B.150mL,100mL?C.100mL,150mL?D.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为______.(不需要化简)
参考答案:(1)在化肥样品中加入NaOH溶液,发生反应为NH4Cl+NaOH═NH3?H2O+NaCl,加热后氨气挥发,剩余NaOH以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,
假设达到滴定终点用去V(mL),根据反应OH-+H+═H2O,可知剩余NaOH的物质的量,
故答案为:以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V(mL);OH-+H+═H2O;
(2)配制盐酸和氢氧化钠溶液时应在烧杯中溶解药品,冷却后用玻璃棒引流至容量瓶中,而量取一定体积的溶液用量筒,称量一定质量的药品用托盘天平称量,两个实验都不用漏斗,
故答案为:AC;
(3)为减小实验误差,提高实验结果的准确度,要重复实验操作1~2,取平均值,
故答案为:减小误差,提高实验结果的准确度;
(4)因为是返滴定法,盐酸用量比氢氧化钠要少,总共要平行测定2-3次,氢氧化钠需要用60-90mL,,A肯定不够,D太浪费,B选项盐酸大于氢氧化钠,显然会造成很多盐酸的浪费,也不能选,只能选C.
故答案为:C;
(5)反应中NaOH的物质的量为30×10-3L×1mol/L,滴定剩余NaOH需要盐酸的物质的量为Vx×10-3L×1mol/L,则NH4+离子的物质的量为30×10-3L×1mol/L-Vx×10-3L×1mol/L,则可计算出化肥中N元素的质量分数为(30×10-3L×1mol/L-Vx×10-3L×1mol/L)×14g/mol1g×100%,
故答案为:(30×10-3L×1mol/L-Vx×10-3L×1mol/L)×14g/mol1g×100%.
本题解析:
本题难度:一般
3、选择题 常温下,用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.1000 mol/L HCl溶液,滴定曲线如图所示。下列说法不正确的是 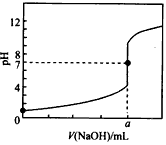
[? ]
A.a=20.00
B.滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-)
C.若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定
D.若将盐酸换成同浓度的醋酸,则滴定到pH=7时,a>20. 00
参考答案:CD
本题解析:
本题难度:一般
4、选择题 下列说法或做法错误的是?
[? ]
①中和滴定用的锥形瓶中加入待测液后,再加少量蒸馏水稀释
②银镜反应实验后的试管可用稀氨水洗涤
③向氯化铁溶液里滴入氢氧化钠溶液可以制取氢氧化铁胶体
④SO2气体通入溴水,溴水褪色,说明SO2有漂白性
⑤向含有乙酸杂质的乙酸乙酯中加入饱和碳酸钠溶液后分液,提纯乙酸乙酯
A.②④⑤
B.①②③
C.②③④
D.全部
参考答案:C
本题解析:
本题难度:一般
5、简答题 酸碱中是中学化学中的重要实验.几位同学对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
(1)甲同学设计完成了一个实验,证明氢氧化钠溶液与盐酸能够发生反应.在盛有稀盐酸的试管中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡溶液,同时测定溶液的pH,直至氢氧化钠过量.
①在实验中要求用试纸测量溶液的pH,如图1所示的操作中正确的是______.(填代号)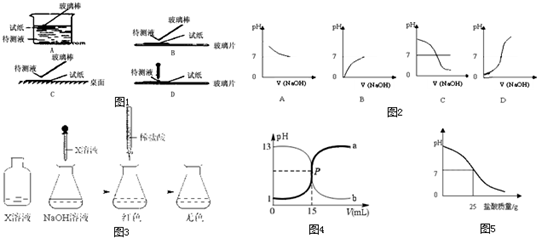
②如图2中哪个图象符合该同学的记录.______(填序号)
(2)乙同学配制100mL1.5mol?L-1氢氧化钠溶液,为了证明氢氧化钠溶液与稀盐酸能发生化学反应,设计并完成了如图3所示的实验.
①X溶液是______,使用酸式滴定管前要检查活塞是否漏水的操作方法是______.
②乙同学用盐酸与氢氧化钠溶液相互滴定,绘制出如图4曲线a和b的滴定曲线.下列叙述正确的是______.
A.盐酸的物质的量浓度为0.1mol?L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.两种反应过程都是放热过程,都可以设计成原电池
(3)丙同学为测定标示质量分数为32%的盐酸的实际质量分数,用pH测定仪组成实验装置.实验时先在烧杯中加入20g40%的氢氧化钠溶液,再逐滴加入该盐酸,测定仪打印出加入盐酸的质量与烧杯中溶液的pH关系图(如图5).
①根据此次测定的结果,该盐酸的实际质量分数是______.
②请分析你的计算结果与标签标示的质量分数不一致的可能原因.______.
参考答案:(1)①测定溶液pH的具体操作方法为:用干净的玻璃棒蘸取待测溶液并滴在pH试纸的中部,把试纸显示的颜色与标准比色卡对照,读出相同颜色的pH值,
故选:B;
②在盛有稀盐酸的试管中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡溶液,同时测定溶液的pH,直至氢氧化钠过量,反应开始前,是盐酸溶液,pH小于7,之后PH逐渐增大,直至溶液呈碱性,pH大于7,
故选:D;
(2)①加入氢氧化钠溶液显示红色,故加入的是酚酞;
将滴定管装满水,夹在滴定台上放置5min,观察流液口及活塞两侧,均不应有水渗出(可用滤纸检查),将活塞转动180°再试一次,也无水渗出即可;
故答案为:酚酞;将滴定管装满水,夹在滴定台上放置5min,观察流液口及活塞两侧,均不应有水渗出(可用滤纸检查),将活塞转动180°再试一次,也无水渗出即可;
②A、根据曲线可以看出盐酸溶液的pH=1,pH=-lgC(H+)=1,所以C(HCl)=C(H+)=0.1mol/L,故A正确;
B、根据曲线可以看出P点时pH=7,说明溶液呈中性,反应恰好完全,故B正确;
C、曲线a的pH是由小到大,说明是氢氧化钠溶液滴定盐酸溶液的曲线,故C错误;
D、盐酸和氢氧化钠反应是非氧化还原反应,不可以设计成原电池,故D错误;
故选:AB;
(3)①设该盐酸的实际质量分数为x、
HCl+NaOH=NaCl+H2O
36.5 40
25g×x 20g×40%
36.525g×x=4020g×40%
x=29.2%
故答案为:29.2%;
②浓盐酸易挥发,放置时间过长会使因会发出氯化氢气体而使自身溶质质量分数减小.
故答案为:浓盐酸具有挥发性,长期放置质量分数减小;
本题解析:
本题难度:一般