时间:2017-07-27 10:32:52
1、选择题 相同状况下,下列气体所占体积最大的是
A.80g?SO3
B.3g?H2
C.16g?O2
D.34g?H2S
参考答案:B
本题解析:分析:根据V=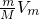 计算气体的体积.
计算气体的体积.
解答:相同条件下,Vm相同,根据V=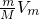 知,气体体积取决于质量和摩尔质量的比值,
知,气体体积取决于质量和摩尔质量的比值,
A.80gSO3的体积=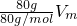 =Vm;
=Vm;
B.3gH2的体积=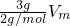 =1.5Vm;
=1.5Vm;
C.16g?O2的体积=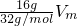 =0.5Vm;
=0.5Vm;
D.34gH2S的体积=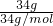 Vm=Vm;
Vm=Vm;
所以气体体积最大是氢气,
故选B.
点评:本题考查阿伏伽德罗定律及其推论,明确气体体积、质量、摩尔质量之间的关系是解本题的关键,难度不大.
本题难度:一般
2、选择题 判断市面上的金首饰是否含有铜,可以取样品与某试剂进行反应,根据现象即可判断,该试剂是
A.浓盐酸
B.硝酸
C.王水
D.稀硫酸
参考答案:B
本题解析:根据金属活动性顺序可知,金和铜均不能在无氧化性酸(盐酸或稀硫酸)中溶解,所以将首饰放入无氧化性的酸中,均不能溶解,但王水有强烈的腐蚀性,在硝酸中不能溶解的铂、金均可以在王水中溶解.硝酸只能溶解铜而不能溶解金.如将含有铜的金首饰放入硝酸中,其中的铜溶解,溶液呈现蓝色.
本题难度:简单
3、选择题 下列关于二氧化硅的叙述中正确的是
①SiO2能与水反应生成硅酸
②SiO2对应的水化物是可溶性弱酸
③硅原子和碳原子的价电子数相同,故SiO2和CO2的电子式相同
④SiO2既能与氢氧化钠反应又能与氢氟酸反应,故SiO2是两性氧化物
⑤SiO2中硅元素为+4价,故SiO2有氧化性
⑥在SiO2中每个硅原子结合2个氧原子
A.①③⑤
B.①④⑥
C.只有③
D.只有⑤
参考答案:D
本题解析:
本题难度:一般
4、选择题 向100 mL0.1 mol·L-1的H3PO4溶液里加入0.1 mol·L-1NaOH溶液230 mL,完全反应后所生成的盐是
A.全部是Na3PO4
B.全部是Na2HPO4
C.Na3PO4和Na2HPO4的混合物
D.Na2HPO4与NaH2PO4的混合物
参考答案:C
本题解析:
本题难度:简单
5、选择题 将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4,NO2)的混合物共0.8mol,这些气体恰好能被500mL?2mol/L?NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O,NO+NO2+2NaOH=2NaNO2+H2O则生成的盐溶液中NaNO3的物质的量为
A.0.4mol
B.0.2mol
C.0.6mol
D.0.8mol
参考答案:B
本题解析:分析:51.2gCu的物质的量为0.8mol,整个过程发生的反应较复杂,但从氧化还原反应电子得失的角度分析可以简化为铜和氮间电子的转移,铜和硝酸反应铜还原硝酸生成氮氧化合物,在NaOH溶液中氮氧化合物又转化成NaNO3和NaNO2,我们可以认为铜将失去的电子给了硝酸在氢氧化钠溶液中生成了NaNO2,根据得失电子数目相等得到2n(Cu)=2n(NaNO2),根据钠元素守恒n(NaNO2)+n(NaNO3)=1mol.据此解答.
解答:51.2gCu的物质的量为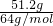 =0.8mol,
=0.8mol,
铜和硝酸反应铜还原硝酸生成氮氧化合物,在NaOH溶液中氮氧化合物又转化成NaNO3和NaNO2,
则铜将失去的电子给了硝酸在氢氧化钠溶液中生成了NaNO2,
根据得失电子数目相等得到2n(Cu)=2n(NaNO2),
所以n(NaNO2)=n(Cu)=0.8mol,
根据钠元素守恒可知n(NaNO2)+n(NaNO3)=0.5L×2mol/L=1mol.
所以n(NaNO3)=1mol-0.8mol=0.2mol.
故选B.
点评:本题考查氧化还原反应的计算,难度较大,整个过程发生的反应较复杂,但从氧化还原反应电子得失的角度分析可以简化为铜和氮间电子的转移,清楚铜将失去的电子给了硝酸在氢氧化钠溶液中生成了NaNO2是解题的关键.
本题难度:一般