时间:2017-07-27 10:24:03
1、填空题
(一)补全以下检验混合物中存在K2CO3的实验步骤及相关现象
1.取混合物样品溶于水,分别取少量溶液进行以下实验
2._________________________________________则一定存在K+;
3.___________________________________________________则一定存在CO32—。
(二)测定K2CO3质量分数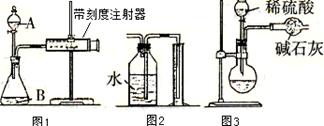
(1)甲同学用图1所示装置,把xg的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。实验开始时检查该装置气密性的方法是?
?。
(2)乙同学用图2代替图1中的收集装置,则所测K2CO3质量分数??(填“偏大”、“偏小”、“不变”),你的改进方案是?。
(3)丙同学用图3装置测定CO2的质量,该装置存在较多缺陷,从而导致实验误差,请你填写其中的三点缺陷:I?;
Ⅱ?
Ⅲ?
参考答案:(一)2. 用焰色反应,同时透过钴玻璃片观看燃烧的火焰,如果是紫色的; 3.加入氯化钡溶液有白色沉淀,再加入盐酸沉淀溶解生成无色无味使澄清石灰水浑浊的气体。
(二)(1)关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;(2)偏小;将水换成饱和碳酸氢钠溶液;
(3):①产生的CO2气体中混有水蒸气,同时被碱石灰吸收,导致结果偏大;②反应结束后装置内残留的CO2气体不能全部排出,导致结果偏小;③球形干燥管与空气相通,也会吸收空气中的CO2和水蒸气,导致结果偏大;④实验开始时,装置内的空气中会有部分CO2也会被碱石灰吸收,导致结果偏大等。
本题解析:略
本题难度:简单
2、实验题 (18分)某中学高一课外兴趣小组为探究铜跟硫酸的反应情况,设计了如图所示装置进行有关实验。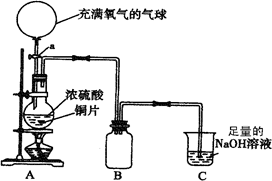
(1)先关闭活塞a,将6.4g铜片和12 mL某浓度的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式:关闭活塞a?;
打开活塞a?;
②B是用来收集实验中产生的气体的装置,但导管未画全,请在上图中把导管补充完整;
③实验结束后,装置C中的溶液中可能含有的溶质有?。
(2)该小组甲同学对“如何检验SO2中混有少许CO2”这个问题很感兴趣,他将A中铜片换作木炭粉,并在A、B之间连接了如下装置: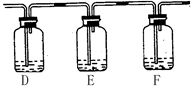
试剂:a. NaOH溶液? b. 品红溶液? c. 酸性KMnO4溶液? d. Ca(OH)2溶液
请回答:
①该同学的实验装置A中发生的化学方程式? ?。
?。
②若要达到此目的,可以在:(填所提供试剂编号)
D中加入?;E中加入?;F中加入?。
(3)事实证实,第(1)问铜片完全消失后,硫酸仍有剩余,乙同学欲测定余酸的物质的量浓度,假设反应前后溶液体积变化忽略不计,他向反应后溶液中加入含溶质a mol 的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式:?mol/L(
的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式:?mol/L( 用含a的代数式表达,若不能,该空不填)。
用含a的代数式表达,若不能,该空不填)。
参考答案:
(1)①Cu+2H2SO4(浓)  CuSO4+SO2?+2H2O;(2分)
CuSO4+SO2?+2H2O;(2分)
2Cu+O2+2H2SO4 2CuSO4+2H2O (2分
2CuSO4+2H2O (2分 )
)
(或分步写成:2Cu+O2=2CuO;CuO+H2SO4=CuSO4+H2O,也可)
②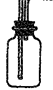 ? (2分)
? (2分)
③NaOH? Na2SO3? Na2SO4?(3分)
(2)①C+2H2SO4(浓)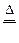 ?CO2?+2SO2?+2H2O?(3分)
?CO2?+2SO2?+2H2O?(3分)
②? c? b? d?(3分)
(3)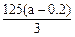 ?(3分,其余合理表达式均可)
?(3分,其余合理表达式均可)
本题解析:略
本题难度:简单
3、选择题 下列关于实验原理或操作的叙述中,正确的 是?(?)
是?(?)
| ? | 相关实验 | 预期目的 |
| A | 把等质量的两份同种大理石块中的一份研成粉末,在同温度下分别与等体积同浓度的盐酸反应,观察放出气体快慢。 | 验证接触面积对化学反应速率的影响。 |
| B | 把装有颜色相同的NO2与N2O4混合气体的小试管(密封)分别浸入热水和冷水中,观察试管中气体颜色变化。 | 验证温度对化学平衡的影响。 |
| C | 直接将表面积相同的铝条和镁条投入同温度滴有酚酞的热水中,观察产生气泡的速率及溶液的颜色变化。 | 比较同周期金属元素的金属性强弱。 |
| D | 将足量氯水分别滴入盛有溴化钠溶液和氯化钠溶液的试管中,观察溶液颜色变化。 | 验证溴元素和碘元素的非金属性强弱。 |
参考答案:CD
本题解析:略
本题难度:简单