时间:2017-07-27 10:20:03
1、填空题 (10分)
汽车尾气中含有CO和氮氧化物。治理尾气的方法是在排气管上安一个催化转化器,可发生如下反应:2NO+2CO N2+2CO2。
N2+2CO2。
(1)2NO(g)+2CO(g) N2(g)+2CO2(g)反应的平衡常数的表达式为:
N2(g)+2CO2(g)反应的平衡常数的表达式为:
K=?。
(2)已知:CO(g)+ O2(g)=2CO2(g)?△H=一283 kJ/mol
O2(g)=2CO2(g)?△H=一283 kJ/mol
N2(g)+O2(g)="2" NO(g)?△H="+180" kJ/mol
则反应2NO(g)+2CO(g) N2(g)+2CO2(g)△H=?kJ/mol。
N2(g)+2CO2(g)△H=?kJ/mol。
(3)对于可逆反应2NO(g)+2CO(g) N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是?。
N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是?。
①升高温度,平衡常数增大
②升高温度,逆反应速率降低
③在单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
④反应达到平衡后,其他条件不变,缩小容器容积,平衡向生成N2和CO2的方向移动
(4)下列说法正确的是?
①NO、CO、CO2均为酸性氧化物
②CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳 出行
出行
③汽车尾气中的氮氧化物主要是空气中的氮气与氧气在高温条件下生成的
(5)实验室可利用NaOH溶液吸收CO2,标准状况下2.24LCO2气体被1.5 L 0.1 mol/L NaOH溶液全部吸收(不考虑CO2溶于水),生成NaCO3的物质的量为?mol。
参考答案:
(1) (2分)
(2分)
(2)-746(2分)
(3)③④(2分)
(4)②③(2分)
(5)0.05(2分)
本题解析:略
本题难度:一般
2、选择题 关于如图所示装置的叙述,正确的是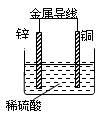
A.锌是正极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
参考答案:D
本题解析:在此原电池中,锌是负极,电极反应为:Zn — 2e—?= Zn2+,锌片质量逐渐减少;铜是正极,电极反应为:2H+ + 2e—?= H2,铜片上有气泡产生;电子从锌极流出经导线流向铜极,D项正确。
本题难度:简单
3、选择题 下列说法正确的是( )
A.化学电池的放电过程就是电能转化为化学能的过程
B.化学电池中电子由正极流出,经外电路流向负极
C.燃料电池两极板均发生氧化还原反应
D.燃料电池工作时,通常是将氧气通向正极
参考答案:A、化学电池的放电过程是原电池的工作过程,所以化学电池的放电过程就是化学能转化为电能的过程,故A错误;
B、化学电池中电子流出的极是负极,电子由负极经外电路流向正极,故B错误;
C、燃料电池两极分别发生氧化还原反应中的一个半反应,两个半反应合并即为完整的氧化还原反应,故C错误;
D、燃料电池反应中,氧元素的化合价降低,通氧气的极是正极,燃料做负极,故D正确.
故选D.
本题解析:
本题难度:一般
4、选择题 关于如图所示装置的叙述,错误的是( )
A.电流从锌片经导线流向铜片
B.氢离子在铜表面被还原,产生气泡
C.锌片是负极,其质量逐渐减少
D.溶液中阳离子向铜片方向移动
参考答案:该装置是原电池,锌作负极,铜作正极,
A.电流从铜片沿导线流向锌片,故A错误;
B.正极铜上,氢离子得电子发生还原反应而生成氢气,故B正确;
C.该原电池中,锌是负极,负极上锌失电子生成锌离子加入溶液,所以锌质量逐渐减少,故C正确;
D.电解质溶液中阳离子向正极铜片方向移动,故D正确;
故选A.
本题解析:
本题难度:一般
5、选择题 已知蓄电池在放电时起原电池的作用,在充电时起电解池的作用。汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成。两个电极用稀硫酸作电解质溶液。在放电时,两极发生的反应可分别表示为:
Pb+S-2e- PbSO4
PbSO4
PbO2+4H++S+2e- PbSO4+2H2O
PbSO4+2H2O
充电时,两极发生的反应分别表示为:
PbSO4+2e- Pb+S
Pb+S
PbSO4+2H2O-2e- PbO2+4H++S
PbO2+4H++S
在蓄电池放电时,溶液的pH将( )
A.不变
B.升高
C.降低
D.无法确定
参考答案:B
本题解析:将放电时的两个电极反应相加可得:Pb+PbO2+2H2SO4 2PbSO4+2H2O,可见,放电时不断消耗H2SO4,c(H+)减小,pH升高。
2PbSO4+2H2O,可见,放电时不断消耗H2SO4,c(H+)减小,pH升高。
本题难度:一般