时间:2017-07-27 10:07:18
1、选择题 某原电池构造如右图所示。下列有关叙述正确的是(?) 
A.取出盐桥后,电流计的指针仍发生偏转
B.在外电路中,电子由银电极流向铜电极
C.原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2
D.盐桥中电子的移动是从右向左
参考答案:C
本题解析:A项取出盐桥后,停止反应,电流计的指针不偏转;B项在外电路中,电子由铜电极流向银电极;C项正确;D项盐桥中没有电子的移动,是离子的移动。
点评:原电池中电子的流向:由负极经导线流向正极,电流反之,属于简单题。
本题难度:一般
2、实验题 (5分)某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
| 实验编号 | 水果种类 | 电极间距离/㎝ | 电流大小/?A |
| ① | 西红柿 | 1 | 98.7 |
| ② | 西红柿 | 2 | 72.5 |
| ③ | 苹?果 | 2 | 27.2 |
参考答案:⑴电极间距离 (1分)?⑵锌片 (1分)?化学能 (1分)
⑶②③ (1分)(两空都对才给分)
⑷电极材料(电极插入水果的深度、电极插入水果的面积、同种水果的成熟程度等其他合理答案均给分) (1分)
本题解析:(1)根据实验过程可以判断,实验目的是探究水果种类和电极间距离对水果电池电流大小的影响。
(2)原电池较活泼的金属作负极,锌比铜活泼,所以锌是负极,铜是正极。原电池是把化学能转化为电能的装置。
(3)实验②③中电极间距离相等,但水果种类不同,所以②③是探究水果种类对电流大小影响的。
(4)本题属于开放性试题,影响电流大小的因素可以是电极材料、电极插入水果的深度、电极插入水果的面积、同种水果的成熟程度等。
本题难度:一般
3、填空题 如图所示的铜-锌原电池中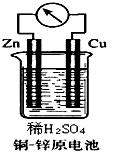
(1)理论上应观察到的现象是
铜片上:__________________锌片上:__________________。
此时原电池的电极反应式是:
正极:__________________负极:__________________。
(2)但在实际实验中,锌片上也有_______________、表面变黑等现象,其原因是_________________。在相同温度下,同样大小的混有碳粒等杂质的锌比纯锌与同浓度同体积的稀硫酸反应的速率_______(选填“要快”、“要慢”、 “相等”、“无法确定”),其微观解释是__________________。
参考答案:
(1)铜片上:有气泡产生;锌片上:锌片逐渐减少
正极:2H++2e-==H2↑;负极:Zn-2e-==Zn2+
(2)气泡产生;锌片也会直接与稀硫酸反应,锌片含有杂质;要快;锌片和碳形成原电池使反应速率加快
本题解析:
本题难度:一般
4、简答题 原电池是化学对人类的一项重大贡献.
(1)某兴趣小组为研究原电池原理,设计如图装置.
①a和b不连接时,烧杯中发生反应的离子方程式是______.
②a和b用导线连接,Cu极为原电池______极(填“正”或“负”),电极反应式是______.Zn极发生______(填“氧化”或“还原”)反应.溶液中H+移向______(填“Cu”或“Zn”)极.
③无论a和b是否连接,Zn片均被腐蚀.若转移了0.2mol电子,则理论上Zn片质量减轻______g.
(2)有同学向把Ba(OH)2?8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?______(填“是”或“否”),理由是______.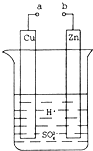
参考答案:(1)①a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应,离子反应方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
②a和b用导线连接,该装置构成原电池,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑;锌失电子发生氧化反应而作负极,放电时,电解质溶液中氢离子向正极铜电极移动,
故答案为:正;2H++2e-=H2↑;氧化;Cu;
③锌片减少的质量=0.2mol2×65g/mol=6.5g,故答案为:6.5;
(2)该反应不是氧化还原反应,且是吸热反应,所以不能设计成原电池,故答案为:否;此反应为非氧化还原反应,且反应吸热.
本题解析:
本题难度:一般
5、填空题 请观察下图装置,回答下列问题:?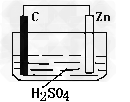
(1)?负极是________,发生_______反应(填氧化或还原) ?
(2)?正极是________,发生_______反应(填氧化或还原) ?
(3)?正极的电极反应式:__________________________?。
参考答案:(1)Zn,氧化
(2)C,还原
(3)2H+ + 2e- = H2↑
本题解析:
本题难度:一般