时间:2017-07-27 10:02:28
1、实验题 (12分)氯碱工业中电解饱和食盐水的原理示意图如下图所示:
(1)溶液A的溶质是?;
(2)电解饱和食盐水的离子方程式是?;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用?;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。
精致流程如下(淡盐水和溶液A来自电解池):
①盐泥a除泥沙外,还含有的物质是?。
②过程Ⅰ中将NH4+转化为N2的离子方程式是?
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有?
④经过程Ⅲ处理,要求盐水中c 中剩余Na2SO3的含量小于5mg /L,若盐水b中NaClO的含量是7.45 mg /L ,则处理10m3盐水b ,至多添加10% Na2SO3溶液?kg(溶液体积变化忽略不计)。
参考答案:(12分,除(1)和①每空1分外,其余每空2分)
(1)NaOH(1分)?(2)2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)氯气与水反应:Cl2+H2O HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
(4)①Mg(OH)2 ?(1分)? ②2NH4++3Cl2+8OH-=8H2O+6Cl-+N2↑
③SO42-、Ca2+? ④1.76( NaClO具有强氧化性,可将Na2SO3氧化成Na2SO4,方程式为Na2SO3+NaClO=Na2SO4+NaCl。10m3盐水b中含NaClO的物质的量为 ,由方程式可知消耗Na2SO3的质量为1mol×126g/mol=126g。若设需要10% Na2SO3溶液的质量为X,则有
,由方程式可知消耗Na2SO3的质量为1mol×126g/mol=126g。若设需要10% Na2SO3溶液的质量为X,则有 ,解得x=1760g,即至多添加10% Na2SO3溶液1.76kg。)
,解得x=1760g,即至多添加10% Na2SO3溶液1.76kg。)
本题解析:略
本题难度:简单
2、填空题 (11分)某课外活动小组用如图装置进行实验,试回答下列问题。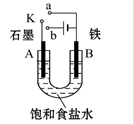
(1)若开始时开关K与a连接,则B极的电极反应式为__________。
(2)若开始时开关K与b连接,则B极的电极反应式为____________,总反应的离子方程式为_________________________________。
(3)若开关K与b连接,下列说法正确的是(填序号)______________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)如果模拟工业上离子交换膜法制烧碱的方法,将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
参考答案:(1)Fe - 2e-===Fe2+ (2分)(2) 2H++2e-=H2↑ (2分)
2Cl-+2H2O Cl2↑+H2↑+2OH- (2分)
Cl2↑+H2↑+2OH- (2分)
(3) ②④ (2分)(4) O2+4e-+2H2O==4OH- (3分)
本题解析:(1) K与a相连,构成原电池,Fe失去电子为原电池负极,电极反应式为Fe - 2e-===Fe2+。(2) K与b相连,构成电解池,电解液为NaCl溶液,B为电解池的阴极, H+在B极放电生成H2,电极反应式为2H++2e-=H2↑。电解过程阳极Cl-失电子生成Cl2,总反应的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-。(3)①电解过程中Na+应该向阴极B移动,错误;②A极为电解池的阳极Cl-失电子生成Cl2,Cl2能将I-氧化为I2,I2遇淀粉变蓝,正确;③根据2NaCl+2H2O
Cl2↑+H2↑+2OH-。(3)①电解过程中Na+应该向阴极B移动,错误;②A极为电解池的阳极Cl-失电子生成Cl2,Cl2能将I-氧化为I2,I2遇淀粉变蓝,正确;③根据2NaCl+2H2O 2NaOH+H2↑+Cl2↑,应通入HCl气体使其恢复到电解前电解质的浓度,若加入盐酸会增加H2O的质量,错误;④B为电解池的阴极,2H++2e-=H2↑,产生2.24L H2,转移0.2 mol电子,正确。(4)O2、H2、KOH溶液构成燃料电池时,O2在电池正极放电:O2+4e-+2H2O=4OH-。
2NaOH+H2↑+Cl2↑,应通入HCl气体使其恢复到电解前电解质的浓度,若加入盐酸会增加H2O的质量,错误;④B为电解池的阴极,2H++2e-=H2↑,产生2.24L H2,转移0.2 mol电子,正确。(4)O2、H2、KOH溶液构成燃料电池时,O2在电池正极放电:O2+4e-+2H2O=4OH-。
考点:考查原电池、电解池原理应用。
本题难度:一般
3、填空题 在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如下图: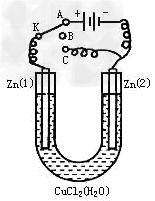
(1)如果把电键K接A,这一装置形成_________装置,Zn①极是________极,其电极反应式是________________________;
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是__________极,该装置发生反应的总化学方程式是___________________________;
(3)上述装置进行2min后,再转换电键K到B,在Zn②极上发生的腐蚀属于________________________,被腐蚀的金属是______________,Zn①极发生的腐蚀主要属于__________________。
参考答案:(1)电解池 阳 Zn-2e-=Zn2+
(2)原电池 负 Zn+CuCl2==Cu+ZnCl2
(3)电化学腐蚀 Zn 化学腐蚀(吸氧腐蚀)
本题解析:
本题难度:一般
4、选择题 下列说法正确的是:
A.向500mL 1 mol/LNa2CO3溶液中,滴加600mL 1 mol /LHCl 得到标况下CO2体积为2.24L
B.电解精炼铜时,若阴极得到2摩尔电子,则阳极质量减少64克
C.将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol·L-1
D.可用pH试纸测得氯水的酸性强弱
参考答案:A
本题解析:向500mL 1 mol /LNa2CO3溶液中,滴加600mL 1 mol /LHCl,发生反应为:H++CO32—==HCO3—,H++ HCO3—==H2O+CO2,通过计算可得生成气体为0.1mol,体积为2.24L,故A项正确;电解精炼铜时,若阴极得到2摩尔电子,则阳极质量减少不一定是64g,因为阳极材料为粗铜,含杂质锌、铁、镍、银、金等,故B项错误;将208 g BaCl2固体溶解在1 L水中,溶液体积并不是1L,形成溶液的浓度不是1 mol·L-1,故C项错误;氯水中存在HclO,具有漂白性,能漂白指示剂,用PH试纸测氯水的酸性强弱最终试纸为白色,故D项错误。
考点:实验基本操作。
本题难度:一般
5、选择题 如图装置,U形管中装有50 mL 2 mol 的CuSO4溶液。通电一段时间后,下列说法正确的是
的CuSO4溶液。通电一段时间后,下列说法正确的是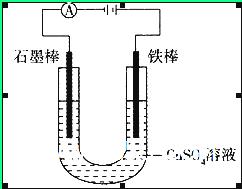
A.转移0.2 mol电子时,阳极减少质量大于阴极增加质量
B.转移0.4 mol电子时,阴极得到2.24 L标准状况下的气体
C.电解一段时间后,U形管中会产生红褐色物质,后来逐渐溶解
D.若将石墨棒换成铜棒,可实现铁制品上镀铜
参考答案:B
本题解析:该电池中硫酸铜的总的物质的量为0.2mol ,可以电离出0.1mol 的铜离子。在阴阳两个电极上分别发生的反应为:阳极:Fe-2e-=Fe2+?阴极:Cu2++2e-=Cu 但是当溶液中的铜离子反应完全之后,就该溶液中由水电离出半的氢离子放电:2H++2e-=H2,因此A、转移0.2 mol电子时,阳极减少质量为5.6g,小于阴极增加质量6.4g,错误;B、转移0.4 mol电子时,阴极得到2.24 L标准状况下的气体-氢气,正确;C、电解一段时间后,U形管中左端碳棒上会产生红褐色物质,后来也不溶解,错误;D、若将石墨棒换成铜棒,可实现铜的精制,而不是铁上镀铜,错误。
本题难度:一般