时间:2017-07-27 09:57:44
1、填空题 已知H2A在水中存在以下平衡:H2A?H++HA-,HA-?H++A2-.回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)?Ca2+(aq)+A2-(aq)△H>0.
①温度升高时,Ksp______(填“增大”、“减小”或“不变”下同).
②滴加少量浓盐酸,c(Ca2+)______,原因是______(用文字和离子方程式说明).
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______.若某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于______(已知Ksp[Cu(OH)2]=2.0×10-20).
(3)常温下,向某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈______性.在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液时所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中电离出的CO32-水解所致,请你设计一个简单的实验方案给甲和乙两位同学的说法进行评判(包括简要操作、现象和结论)______.
参考答案:(1)①已知CaA(s)?Ca2+(aq)+A2-(aq)△H>0,升高温度,促进难溶物的电离,所以导致溶度积常数变大,故答案为:增大;
②已知H2A在水中存在以下平衡:H2A?H++HA-,HA-?H++A2-,则该酸为弱酸,加盐酸发生反应:A2-+H+?HA-,A2-浓度减小,CaA的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大,
故答案为:增大;加盐酸发生反应:A2-+H+?HA-,A2-浓度减小,CaA的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大;
(2)CaA悬浊液中加入CuSO4溶液,发生复分解反应,生成一种黑色固体物质CuA,离子方程式为CaA(s)+Cu2+(aq)?Ca2+(aq)+CuA(s);
某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(OH-)≥
本题解析:
本题难度:一般
2、选择题 难溶电解质AB2饱和溶液中,c(A2+)=xmol·L-1,c(B-)=ymol·L-1,则Ksp值为
[? ]
A.1/2 xy2
B.xy
C.xy2
D.4xy2
参考答案:C
本题解析:
本题难度:一般
3、选择题 查阅资料得知Fe3+、Mg2+、Al3+在浓度均为0.1mol?L-1时,氢氧化物沉淀的pH如下表:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 开始沉淀的pH 2.3 10.8 3.7 开始溶解的pH:7.8 完全沉淀的pH 4.3 12.4 5.2 完全溶解的pH:10.0 | |
参考答案:若要从含Fe3+、Mg2+、Al3+的混合溶液中,只得到Fe(OH)3沉淀,应防止生成Mg(OH)2和Al(OH)3沉淀,可调节pH2.3~3.7,此时只生成Fe(OH)3沉淀,
或调节pH10.0~10.8使Fe3+转化为Fe(OH)3,而Al3+转化为AlO2-,
此时溶液中Mg2+没有转化生成Mg(OH)2沉淀,
故选C.
本题解析:
本题难度:一般
4、填空题 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。 
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+__________+_________
②5Ca(OH)2+3H3PO4=_________________
(2)与方法A相比,方法B的优点是____________________________。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是________________________。
(4)图中所示3种钙盐在人体中最稳定的存在形式是______________________(填化学式)。
(5)糖黏附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因
_________________________________。
参考答案:(1)①10NH4NO3、3H2O;②Ca5(PO4)3OH↓+9H2O
(2)唯一副产物为水,工艺简单
(3)反应液局部酸性过大,会有CaHPO4产生
(4)Ca5(PO4)3OH
(5)酸性物质使沉淀溶解平衡Ca5(PO4)3OH(s)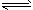 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致
Ca5(PO4)3OH溶解,造成龋齿
本题解析:
本题难度:一般
5、实验题 工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F. 移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。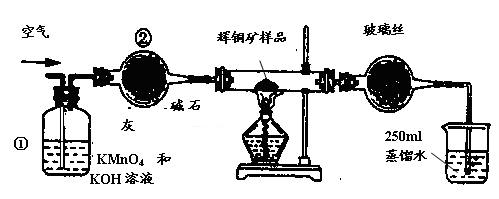
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为?,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
参考答案:(1)除去空气中的还原性气体与酸性气体;?干燥空气
(2)2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O?
滴入最后一滴标准KMnO4溶液后,溶液由无色变为淡紫色,并在半分钟内不褪色
(3)80%
(4)在KMnO4滴定前,未反应完的SO2与空气中的O2也可将H2SO3氧化,造成测定结果偏低
(5)4 ×10-3mol/L
本题解析:(1)装置①溶液含有KMnO4具有氧化性,可吸收空气中的还原性气体,NaOH可吸收酸性气体;装置②含有碱石灰,具有吸水性,可干燥空气。
(2)操作F中KMnO4氧化H2SO4,配平可得化学方程式:2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O;滴定达到终点时,H2SO3完全反应,所以现象为:滴入最后一滴标准KMnO4溶液后,溶液由无色变为淡紫色,并在半分钟内不褪色。
(3)三次滴定标准液的体积分别为:19.99mL、20.01mL、18.04mL,第三次滴定的体积差别较大,数据出现了错误,应舍去,前两次滴定标准液的平均体积为20.00mL,根据化学方程式可得物质的对应关系为:5Cu2S ~ 5SO2~ 5H2SO3~ 2KMnO4,则辉铜矿样品中Cu2S的质量分数="0.02L×0.0100mol/L×5/2×10×160g/mol÷1.000g×100%" =80%
(4)SO2能被空气中的O2氧化,所以在KMnO4滴定前,未反应完的SO2与空气中的O2也可将H2SO3氧化,造成测定结果偏低。
(5)(Fe2+)为 lmol/L,则c(S2-) = Ksp(FeS)÷c(Fe2+)=" 6" . 25 × 10 -18÷1="6" . 25 × 10 -18,带入c2 (H+) ·c(S2-) =" 1" . 0×10-22,可得c(H+)="4" ×10-3mol/L
本题难度:一般