时间:2017-07-27 09:57:23
1、选择题 下列关于晶体与非晶体的说法中正确的是
[? ]
A.固体SiO2一定是晶体
B.晶体有自范性但排列杂乱无章
C.非晶体无自范性而且排列无序
D.非晶体一定比晶体的熔点高
2、选择题 下列分子的立体结构,其中属于直线型分子的是
[? ]
A.H2O
B.CO2
C.C2H2
D.P4
3、实验题 有A、B、C三种晶体,分别由H、C、Na、Cl四种元素中的一种或几种组成,对三种晶体元素进行实验,结果如下表:
| 代号 | 熔点 | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
| A | -114.2 ℃ | 很小 | 易溶于水 | 水溶液导电,液态不导电 | 有白色沉淀产生 |
| B | 801 ℃ | 较大 | 易溶于水 | 溶于水或熔化均导电 | 有白色沉淀产生 |
| C | 3 350 ℃ | 很大 | 不溶于水 | 不导电 | 无反应 |
4、填空题 ?【化学――选修物质结构与性质】(15分)
有A、B、C、D、E五种元素。其相关信息如下:
请回答下列问题。
(1) 写出E元素原子基态时的电子排布式__________________;
(2) C元素的第一电离能比氧元索的第一电离能 ______ ______ (填“大”或“小”);
(3) CA3分子中C原子的杂化轨道类型是____________;
(4) A、C、E三种元素可形成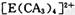 配离子,其中存在的化学键类型有 ______ (填序号);
配离子,其中存在的化学键类型有 ______ (填序号);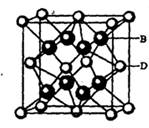
①配位键 ②金属键③极性共价键④非极性共价键⑤离子键 ⑥氢键
若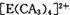 具有对称的空间构型,且当
具有对称的空间构型,且当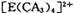 中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则
中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则 的空间构型为 ____________ (填序号);
的空间构型为 ____________ (填序号);
a.平面正方形b.正四面体c.三角锥型 ?d. V型
(5) B与D可形成离子化合物,其晶胞结构如右图所示。其中D离子的配位数为_____,若该晶体的密度为ag ? cm-3,则该晶胞的体积是______cm-3(写出表达式即可)。
5、选择题 下列判断错误的是( )
A.熔点:Si3N4>NaCl>SiI4
B.沸点:NH3>PH3>AsH3
C.酸性:HClO4>H2SO4>H3PO4
D.碱性:NaOH>Mg(OH)2>Al(OH)3