时间:2017-07-27 09:44:12
1、选择题 现将足量的AgCl(s)分别放入下列物质中,所得溶液中c(Ag+) 浓度最小是
A.10 mL 0.1mol·L-1MgCl2溶液
B.20 mL 0.5 mol·L-1 AgNO3溶液
C.40 mL 0.1mol·L-1HCl溶液
D.5 mL蒸馏水
参考答案:A
本题解析:AgCl在溶液中存在:AgCl(s) Ag+(aq) +Cl-(aq)。A中AgCl(s)分别放入到 0.1mol·L-1MgCl2溶液中,c(Cl-)="0.2" mol·L-1, Cl-对AgCl(s)的溶解起到抑制作用,所以c(Ag+)很小;B中加入到0.5 mol·L-1 AgNO3溶液,c(Ag+)主要由AgNO3电离出来的Ag+决定,约为0.5 mol·L-1,C中 0.1mol·L-1HCl溶液也对AgCl(s)的溶解起到抑制作用,但c(Cl-)="0.1" mol·L-1,所以抑制作用比A中的要小,c(Ag+)比A中的要大;D中蒸馏水对AgCl的溶解平衡无影响;故c(Ag+)最小的是A。
Ag+(aq) +Cl-(aq)。A中AgCl(s)分别放入到 0.1mol·L-1MgCl2溶液中,c(Cl-)="0.2" mol·L-1, Cl-对AgCl(s)的溶解起到抑制作用,所以c(Ag+)很小;B中加入到0.5 mol·L-1 AgNO3溶液,c(Ag+)主要由AgNO3电离出来的Ag+决定,约为0.5 mol·L-1,C中 0.1mol·L-1HCl溶液也对AgCl(s)的溶解起到抑制作用,但c(Cl-)="0.1" mol·L-1,所以抑制作用比A中的要小,c(Ag+)比A中的要大;D中蒸馏水对AgCl的溶解平衡无影响;故c(Ag+)最小的是A。
考点:溶解平衡的影响和离子浓度的大小比较。
本题难度:一般
2、选择题 在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24.下列有关说法中正确的是( )
A.25℃时,CuS的溶解度大于ZnS的溶解度
B.25℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36mol?L-1
C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
参考答案:A、25℃时,CuS的溶度积小于ZnS,二者阴阳离子比相同,说明CuS溶解度小,故A错误;
B、硫化铜饱和溶液中依据溶度积常数计算铜离子浓度,Ksp=1.3×10-36=c(Cu2+)c(S2-),则c(Cu2+)=
本题解析:
本题难度:简单
3、填空题 (13分)高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:
根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
(2)通常条件下Ksp〔Fe(OH)3〕=4.0×10—38,除杂后溶液中c(Fe3+)约为 。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
(5)“分离”操作的名称是 (填字母代号)。
A.蒸馏 B.分液 C.过滤
(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是 ,离子浓度最小的离子是 。
参考答案:(13分) (1) 2Fe2++H2O2+4NH3·H2O=2Fe(OH)3↓+4NH4+
(2)4×10—20mol/L(3分)。(3)抑制(防止)Al3+水解。(2分)
(4)防止晶体失去结晶水,避免可溶性杂质结晶析出(2分,答对1点给1分)。
(5)C(1分)。(6)SO42—,OH—。(共2分,各1分)
本题解析:(1)H2O2可以把Fe2+氧化为Fe3+,然后加入氨水,就会形成Fe(OH)3沉淀而过滤除去,反应的离子方程式是2Fe2++H2O2+4NH3·H2O=2Fe(OH)3↓+4NH4+;(2)pH=8.0,则c(OH—)=10-6mol/L,在通常条件下Ksp〔Fe(OH)3〕=c(Fe3+)·c3(OH—)=4.0×10—38,所以c(Fe3+)= Ksp〔Fe(OH)3〕÷c3(OH—)= 4.0×10—38÷10-18=4×10—20mol/L;(3)硫酸铝是强酸弱碱盐,水解产生氢氧化铝胶体和硫酸,加入硫酸就可以抑制盐电离产生的Al3+的水解;(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干是因为蒸干容易使晶体失去结晶水,这样还避免可溶性杂质结晶析出;(5)把晶体从混合物中“分离”操作的名称是过滤;(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L在铵明矾的水溶液中,根据物料守恒可知离子浓度最大的离子是SO42—,由于该盐是强酸弱碱盐,NH4+、Al3+水解消耗水电离产生的OH-,使溶液显酸性,所以离子浓度最小的离子是OH—。
考点:考查物质制取的知识,包括反应条件的选择、离子方程式的书写、溶度积常数的应用、盐的水解、离子浓度的大小比较的知识。
本题难度:困难
4、填空题 牙齿的损坏实际是牙釉质[Ca5(PO4)3OH]溶解的结果,在口腔中存在如下平衡:Ca5(PO4)3OH?5Ca2++3PO43-+OH-当糖附在牙齿上发酵时会产生H+,试运用化学平衡理论说明经常吃糖对牙齿的影响.
参考答案:牙齿的坚固部分主要成份是Ca5(PO4)3OH,糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿.其原因是在酸性条件下,H+与牙釉质溶解得到的OH-结合成水,平衡正向进行,Ca5(PO4)3OH溶解,牙釉质溶解造成龋齿;
答:糖附在牙齿上发酵时会产生H+,在酸性条件下Ca5(PO4)3OH溶解,造成龋齿.
本题解析:
本题难度:一般
5、选择题 用石墨电极在一定温度下电解K2SO4饱和溶液m g。当阴极产生a mol气体时,从溶液中析出n g无水晶体。则剩余溶液的溶质质量分数是?(?)
A.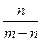
B.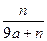
C.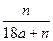
D.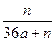
参考答案:C
本题解析:略
本题难度:简单